硅基导向的催化不对称Nazarov环化
朱守非课题组使用Lewis酸和手性Brønsted酸协同催化体系,首次实现了硅基导向的不对称Nazarov反应,高效合成了具有重要应用前景的多取代手性环戊烯酮,进一步拓展了“手性质子梭催化剂”的应用范围。相关成果发表于J. Am. Chem. Soc.(https://doi.org/10.1021/jacs.1c01194)。
手性环戊烯酮是一类重要的合成中间体,并且作为核心骨架广泛存在于天然产物和药物分子中。Nazarov反应是构筑多取代、官能化的环戊烯酮结构的重要方法。近年来,催化不对称Nazarov环化反应也取得一系列重要进展。但是由于Nazarov环化反应经历了碳正离子中间体,若底物存在多个β氢位点,均有可能发生碳正离子的β-氢消除,则难以获得单一产物。在以往的报道中,人们在底物中引入环状烯烃结构或者芳环结构,利用环结构中碳正离子的稳定性或芳构化作用将产物的双键控制在多取代烯烃一侧(图1a);或者向底物两侧烯烃上分别引入推、拉电子基团,使碳正离子稳定在给电子基团一侧,进而确定产物的双键位置(图1b)。但是上述策略主要依赖底物设计,严重限制了所合成手性环戊烯酮产物的结构多样性(图1)。
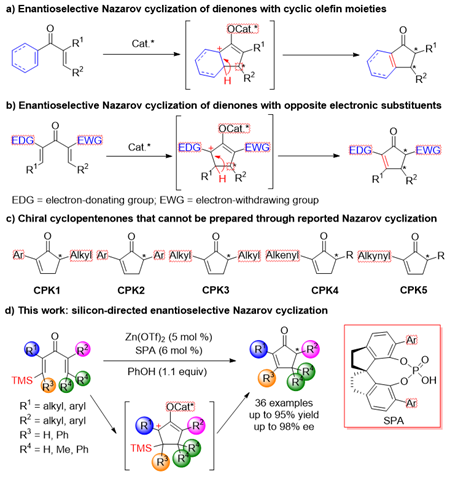
图1. 研究背景及该文工作。图片来源:
J. Am. Chem. Soc.
1982年,Denmark等人(J. Am. Chem. Soc. 1982, 104, 2642.)将硅基作为导向基引入底物,利用β硅效应导向环化后产生的碳正离子,随后硅基消除生成双键,避免了其他异构体的产生。但是此类反应活性比较低,需要使用当量或者亚当量的强Lewis酸或Brønsted酸;并且,由于缺少合适的手性催化剂,这类反应的对映选择性转化一直没有实现。最近,南开大学化学学院朱守非课题组发展了Lewis酸和手性Brønsted酸协同催化体系,实现了首例硅基导向的不对称Nazarov环化反应(图 1d)。Lewis酸和Brønsted酸协同催化体系显著提高了反应的活性,同时实现了反应对映选择性的有效控制。该反应底物适用范围很广,双键位置单一,对映选择性高,可用于多种取代手性环戊烯酮的高效合成。相关成果发表于J. Am. Chem. Soc.(https://doi.org/10.1021/jacs.1c01194),曹晋和胡梦阳是文章的共同一作。
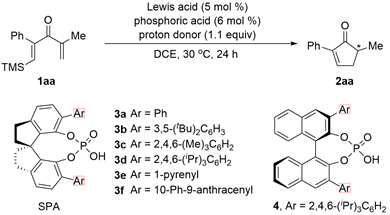
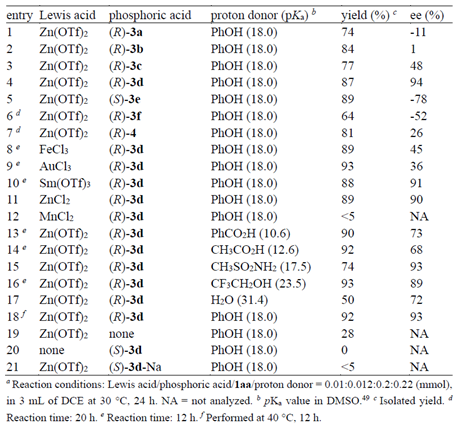
图2. 反应条件优化。图片来源:
J. Am. Chem. Soc.
研究者选取1aa作为模型底物,首先对手性螺环磷酸3进行了评价(图2, entries 1-7)。当使用大位阻芳基取代的(R)-3d时,给出最高的对映选择性(94% ee,entry 4)。Lewis酸对反应的活性和对映选择性都有明显影响(entries 8-12),Lewis酸性较弱的MnCl2不能催化反应发生(entry 12)。质子源的pKa和反应的结果有明显的关联:酸性较弱的H2O使反应变慢,对映选择性也有所降低(entry 17);酸性较强的羧酸可以使反应明显加速(entries 13和 14);和苯酚酸性接近的三氟乙醇以及甲磺酰胺给出和苯酚类似的结果(entries 15 和 16)。进一步研究表明,当反应在40 oC下进行时,速度明显加快,而对映选择性基本保持(entry 18)。Lewis酸可以单独催化反应发生,但收率大幅下降(entry 19)。当只使用手性磷酸作为催化剂(entry 20),或使用磷酸钠盐替代手性磷酸时(entry 21),反应不能发生。
研究者进而考察了该反应底物的普适性(图3)。当底物R1为苯基或者取代苯基时,反应都能以优秀的收率(83-93%)和对映选择性(87-95% ee)获得目标产物(2aa−2ai)。将反应放大至克级规模,收率和对映选择性均能保持。底物带有稠环和杂芳环也能取得优秀的结果(2aj-2al)。固定R1一侧为苯基,R2基团可以为直链烷基(2ba-2bc)、支链烷基(2bd和2be)和官能化的烷基(2bf-2bh)等,所有反应都可以顺利发生,给出令人满意的收率(73-94%)和对映选择性(65-97% ee)。当R1和R2均为芳基(2ca-2cc),甚至两侧基团完全相同时(2ca),反应仍能获得不错的结果。R1和R2也可以都是烷基取代基(2da-2de),反应能以高达92%的收率和91%的对映选择性获得相应产物。R1也可以为烯基和炔基(2ea和2fa);甚至对于多取代二烯酮底物(2ga-2gc,2ha,2ia),反应也能获得优秀的收率和对映选择性。但当R4为单取代时(2ga-2gc),反应的dr值不高,说明在现有条件下底物β位的立体化学不能很好的控制。
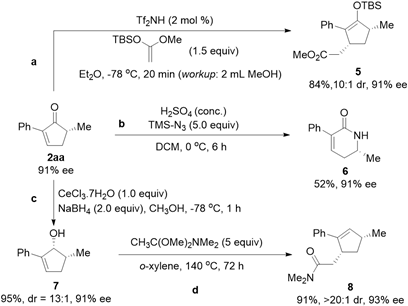
图4. 产物转化。图片来源:
J. Am. Chem. Soc.
接下来研究者进行了产物转化来展示该方法学的应用潜力(图4)。环戊烯酮2aa可以作为Michael受体应用在Mukaiyama−Michael加成反应中合成具有两个手性中心的稳定烯醇硅醚化合物5。同样的,该产物可以通过Schmidt反应对映选择性保持地合成手性内酰胺6。进一步,2aa能以很高的dr值还原为对应的烯丙醇,随后经过Eschenmoser−Claisen重排反应获得具有双手性中心的化合物8。
为了探索反应机理,研究者考察了底物上的硅基对反应的影响(图5a)。结果表明,增大硅基取代基会显著降低反应活性和对映选择性。而底物硅基的构型对反应的对映选择性也有很大影响(1aa和1la)。研究者利用在线红外光谱分析仪研究了反应的动力学(图5b)。实验表明,反应对底物、苯酚为一级,对手性磷酸为零级。而Zn(OTf)2在低浓度下表现为零级,但随着其浓度升高会对反应有明显的加速作用。研究者认为,该反应的实际历程很有可能会随着Zn(OTf)2与手性磷酸在体系中的比例不同而发生变化。当Zn(OTf)2的浓度小于手性磷酸时,底物、PhOH参与到反应决速步中(r = k[1aa][PhOH]);当Zn(OTf)2的浓度大于手性磷酸时,底物、PhOH、Zn(OTf)2参与到反应决速步中(r = k[1aa][Zn(OTf)2][PhOH])。
根据上述机理实验,研究者提出了可能的反应机理(图6)。底物首先被Zn(OTf)2和PhOH活化经历4π电环化生成中间体INT-1。此时TMS基团和配位的苯酚之间存在顺反两种构型(INT-1和INT-1’)。在INT-1中,配位的苯酚可能会发生分子内进攻脱除硅基生成自由烯醇INT-2,随后经历手性磷酸促进的不对称质子转移过程获得目标产物。在整个催化循环中,硅原子独特的电子效应使得碳正离子可以定位在硅基的β位,因此反应可以获得高区域选择性。烯醇中间体INT-2的不对称质子转移是反应的手性决定步。在这一步中,手性磷酸作为“手性质子梭”,通过氢键相互作用实现了反应的立体化学控制(Science 2019, 366, 990; J. Am. Chem. Soc. 2020, 142, 10557; J. Am. Chem. Soc. 2015, 137, 8700; Angew. Chem. Int. Ed. 2011, 50, 11483; Angew. Chem. Int. Ed. 2014, 53, 3913)。动力学研究表明,硅基的消除可能是反应的决速步。手性磷酸虽然没有直接参与到决速步中,但是它可能通过降低质子转移过程的反应能垒来加速整体反应的进行。当硅基和配位的苯酚处于反式时(INT-1’),反应可能经历分子间脱硅生成烯醇锌和苯酚鎓离子(INT-2’),随后发生不受手性磷酸调控的直接的碳-质子化过程生成低对映选择性产物。因为硅基的大小和构型会影响反应中两种中间体的比例(INT-1和INT-1’),进而导致反应经历不同的历程(path a和path b),所以硅基对于反应的对映选择性会产生显著影响。

图6. 反应机理建议。图片来源:
J. Am. Chem. Soc.
总之,朱守非课题组使用Lewis酸和手性Brønsted酸协同催化体系,首次实现了硅基导向的不对称Nazarov反应。该研究不仅为取代类型丰富的手性环戊烯酮合成提供了有效方法,其新颖的催化体系和催化机制也为不对称Nazarov反应的研究提供了新的思路,并进一步展示了该课题组提出的“手性质子梭催化剂”的广阔应用前景。
