铜催化环丙烯的开环硼化反应
朱守非课题组发展了铜催化环丙烯开环硼化新反应,合成了一系列立体构型单一的3,3-二取代的烯丙基硼烷类化合物。该研究拓展了催化卡宾对B-H键插入的反应类型,为烯丙基硼的合成提供了新的思路。相关成果发表于CCS Chemistry(2021, 3, 1721. DOI: 10.31635/ccschem.021.202100921)。
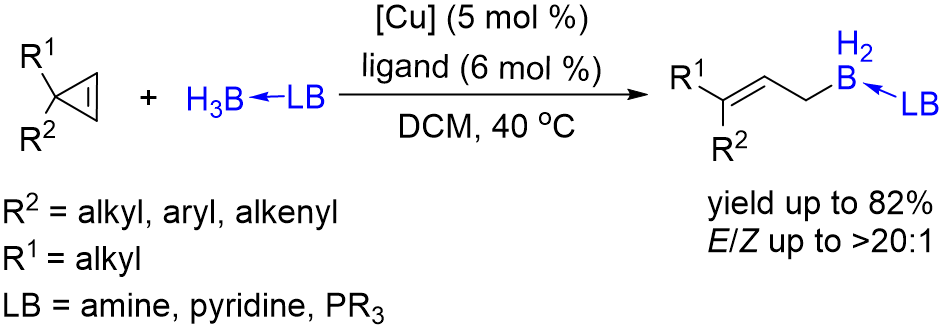
有机硼化合物在有机合成、药物化学以及材料化学等领域都有着广泛的应用,因此发展构筑C-B键的新方法也一直是合成化学研究的热点。过渡金属催化卡宾对硼氢键的插入反应是高效构筑C-B键的重要方法。该反应自2013年被首次发现以来,人们先后实现了以重氮化合物、炔烃或者亚砜叶立德为卡宾前体的催化硼氢键插入反应,合成了一系列新型有机硼化合物。此外,通过不饱和卡宾对硼氢键的插入反应来构筑C(sp2)-B键的方法最近也被报道。近日,南开大学化学院的朱守非教授课题组实现了Cu(I)催化的环丙烯开环硼化新反应,合成了一系列立体构型单一的3,3-二取代的烯丙基硼烷类化合物。该研究拓展了催化卡宾对B-H键插入的反应类型,为烯丙基硼的合成提供了新的思路。相关成果发表于CCS Chemistry(2021, 3, 1721. DOI: 10.31635/ccschem.021.202100921),黄明耀与赵宇涛是文章的共同一作。
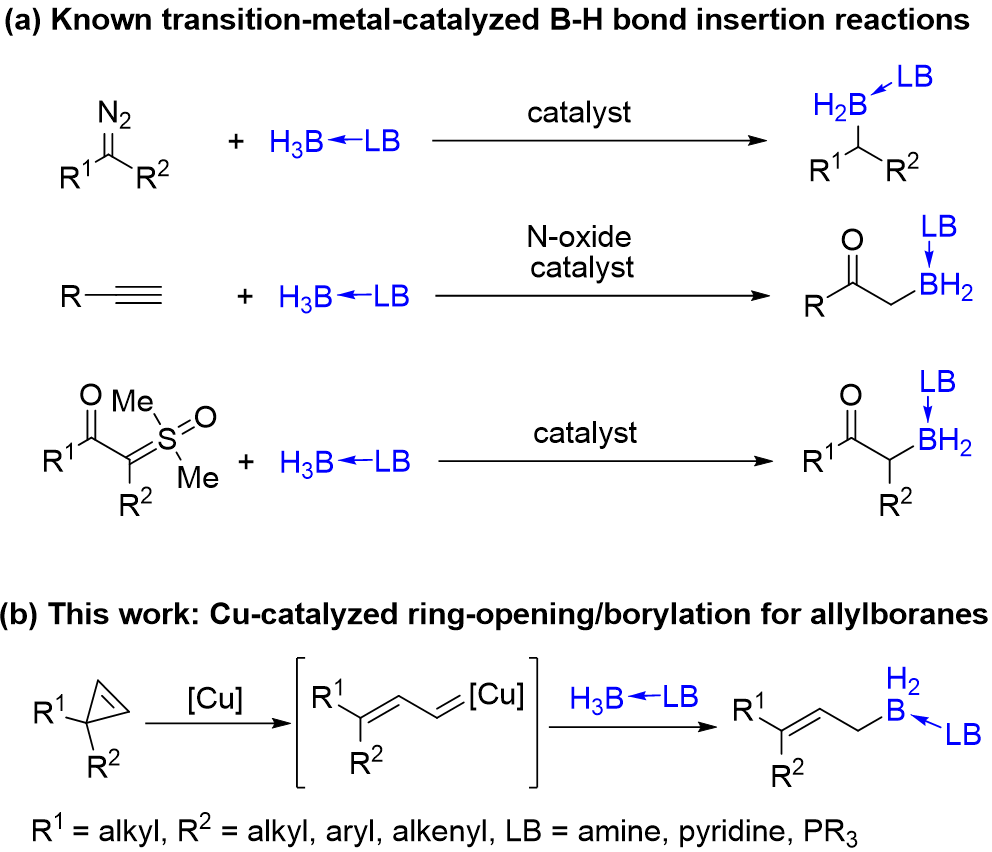
图 1 过渡金属催化B-H键插入反应
研究者选取3a作为模型底物,以Cu(MeCN)4PF6作为铜盐前体,对一系列双磷以及单磷配体进行了评价。不加配体时,主要观察到二聚的副产物(entry 1);使用双磷配体则会抑制反应(entry 2-3);只有使用合适位阻的联苯类单磷配体Johnphos(L3)时,反应才能给出最优的收率(entry 4)。反应在40 oC下进行时,速度明显加快,且收率略有提高(entry 16)。
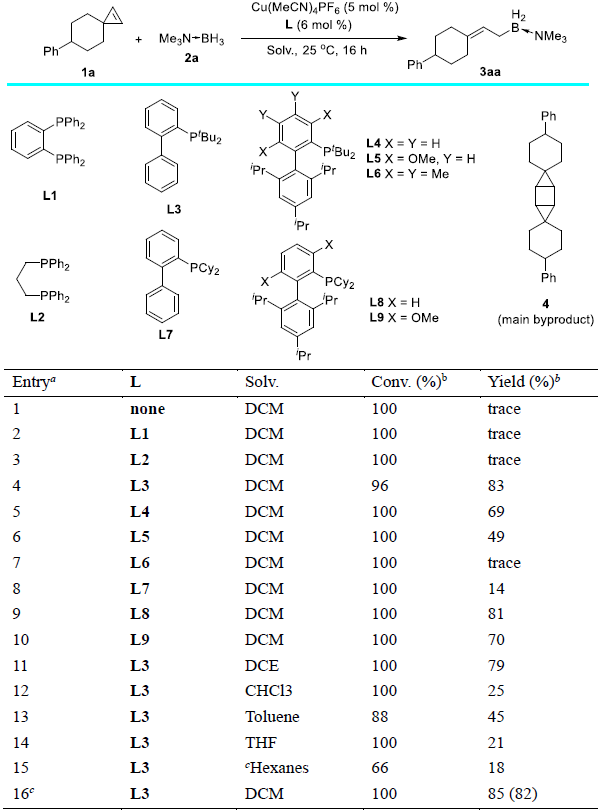
aReaction conditions: 1a/2a/Cu(MeCN)4PF6/L = 0.2/0.8/0.01/0.012 (mmol), in 2 mL of solvent. bConversion and yield were determined by 1H NMR analysis using 1,3,5-trimethoxylbenzene as an internal standard. The main byproduct was dimer 4. Value in the parenthesis was isolated yield in 0.3 mmol scale. cReaction was performed at 40 °C for 12 h.
图 2 条件优化
研究者进而考察了底物的适用范围。对于对称的3,3-二烷基环丙烯底物,反应能够以良好的收率(71-82%)给出目标产物(3aa-3da)。对于非对称的3,3-二烷基环丙烯,反应存在立体选择性的问题。当两个取代基的位阻差异足够大时,比如甲基金刚烷基环丙烯(3ea),反应能够得到单一的E式产物;而当位阻差异较小时,比如甲基环己基环丙烯(3fa)、乙基环己基环丙烯(3ga)以及甲基环戊基环丙烯(3ha)等,通过使用较大位阻的BrettPhos(L9)配体,这类底物的立体选择性能够得到较好的调控;当位阻差异很小时,比如甲基苄基环丙烯(3ia),产物的E/Z比则较低。
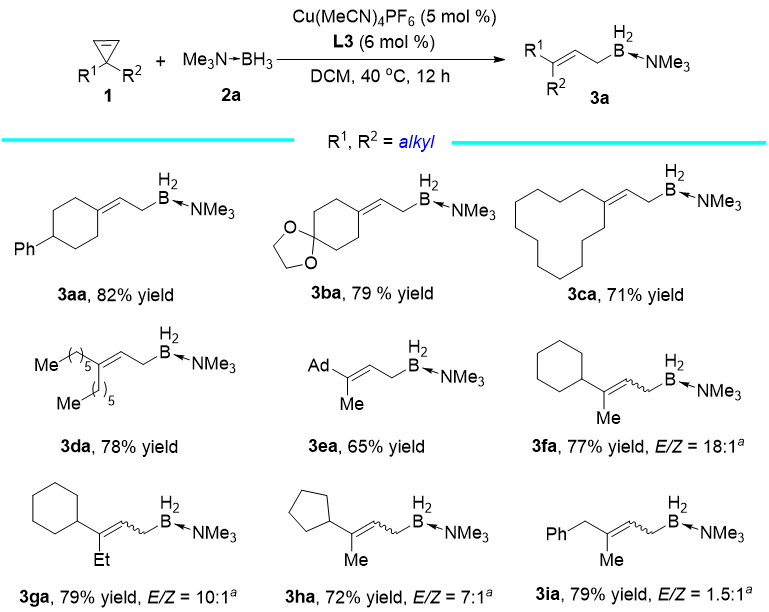
Reaction conditions: 1/2a/Cu(MeCN)4PF6/L3 = 0.3/1.2 /0.015/0.018 (mmol), in 3 mL of DCM. Isolated yields were given. The E/Z ratio of the product is > 20:1 unless otherwise noted. Ad = adamantyl. aL9 was used at 25 °C for 16 h.
图 3 3,3-二烷基环丙烯底物评价
有趣的是,对于3-芳基-3-烷基环丙烯(6aa, 6sa),反应大都仅能得到E式的目标产物,以及少量分子内C-H键插入的副产物。通过使用BrettPhos(L9)配体,反应能够以良好或中等的收率得到E式的3-芳基-3-烷基的烯丙基硼产物。反应对底物芳基的位阻以及电性较为敏感,邻位取代基会抑制反应(6ia),强吸电子取代基会显著降低反应收率同时产生少量Z式产物(6fa)。此外,对于3-烯基-3-烷基环丙烯(6ta, 6ua),反应也能以单一选择性得到E式的插入产物。对于双芳基环丙烯,反应主要得到分子内环化的副产物(6va, 6wa)。
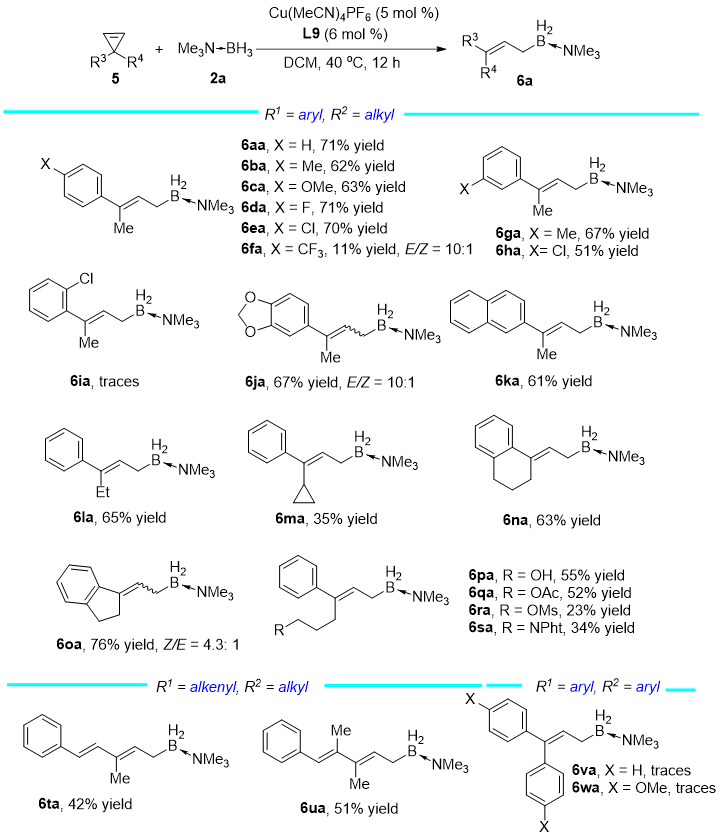
Reaction conditions: 5/2a/Cu(MeCN)4PF6/L9 = 0.3/1.2 /0.015/0.018 (mmol), in 3 mL of DCM. Isolated yields were given. The E/Z ratio of the product is > 20:1 unless otherwise noted.
图 4 3-芳基(烯基)-3-烷基环丙烯底物拓展
接下来研究者进行了放大量实验和产物转化研究(图5)。将反应放大到5 mmol,仍然能以71%的收率得到目标产物6aa。通过与醇或酸反应,产物硼烷加合物能够转化为相应的硼酸酯7或8;直接在空气中加热能将产物硼烷加合物氧化为醇9;产物还能在水的存在条件下直接与芳基醛或者烷基醛发生立体专一性的烯丙位硼化反应,以很高的非对映选择性得到高烯丙醇类化合物10和11;此外,通过与NCS反应,能到得到单氯代的胺硼烷加合物12。这些实验表明该反应具有很好的应用前景。
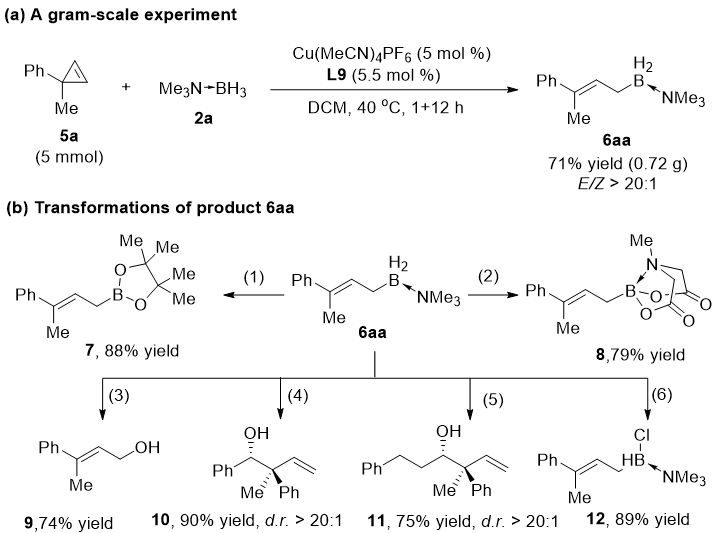
(1) pinacol, THF, 70 °C, 2 h; (2) N-methyl imidodiacetic acid, toluene/DMSO = 5:1, 70 °C, 4 h; (3) H2O, air, THF, 60 °C, 12 h; (4) H2O, PhCHO, THF, 60 °C, 6 h; (5) H2O, THF, 70 °C, 4 h, then phenylpropyl aldehyde, 4Å MS, 4h; (6) N-chlorosuccinimide, DCM, rt, 5 min.
图 5 产物转化
研究者随后对反应的机理进行了探究。氘代实验表明反应很有可能经历卡宾过程(图 6a);反应展现出很小的动力学同位素效应,说明氢转移是快步骤(图 6b);而交换实验表明反应过程中不存在H-D交换(图 6c);另外,当使用不同的硼烷加合物进行反应时,硼氢插入的产物与分子内碳氢插入的副产物比例几乎一致,说明硼烷加合物对环丙烯开环的选择性没有影响(图 6d)。
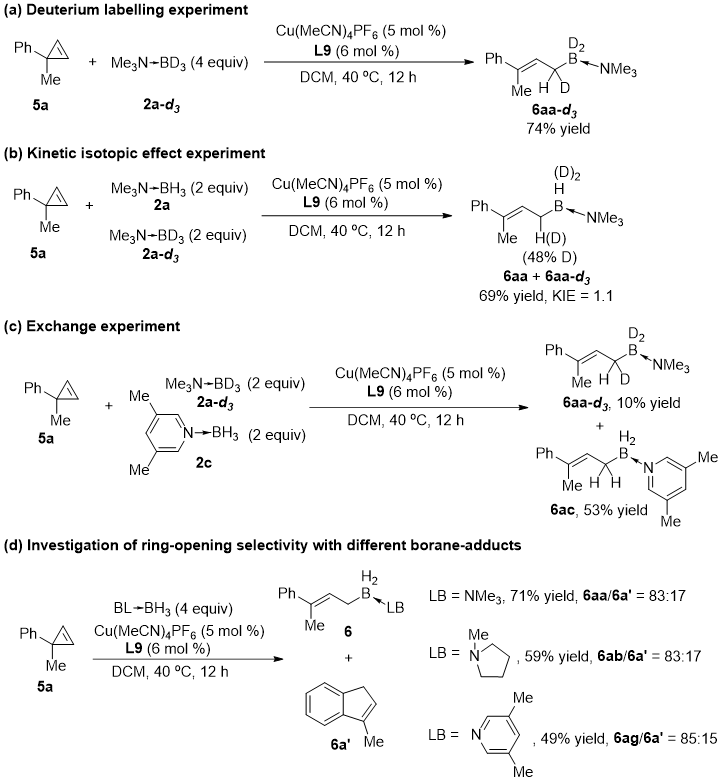
图 6 控制实验
基于以上控制实验,研究者提出了可能的反应机理(图7)。首先,在铜络合物的作用下,环丙烯发生开环生成E式或Z式的烯基铜卡宾,这一步是反应的决速步且选择性可由配体调控。E式卡宾与硼烷加合物通过三元环的协同过渡态发生硼氢键插入反应生成烯丙基硼产物,而Z式卡宾则更倾向对同侧芳基发生亲电加成,之后发生氢迁移得到形式上的C-H键插入的副产物。因此最后仅能得到E式的硼氢键插入产物。
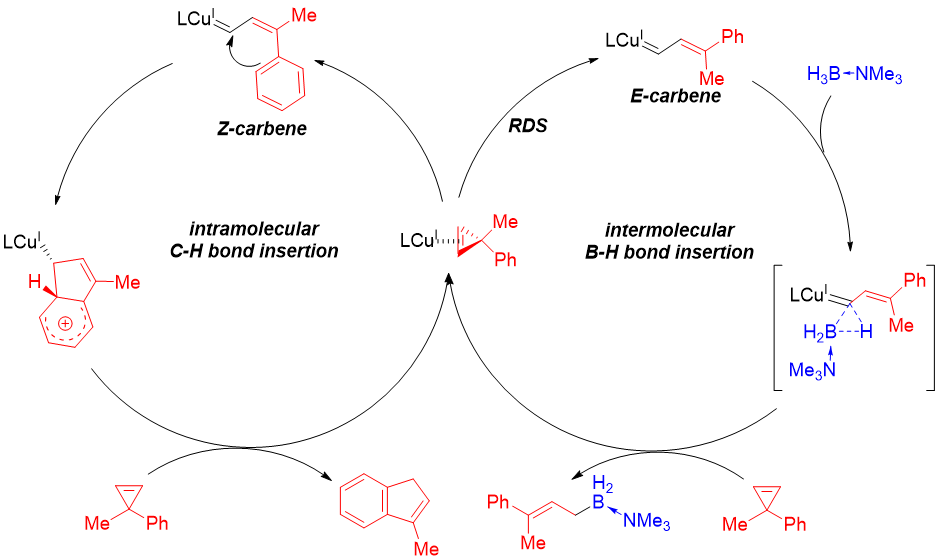
图 7 可能机理
总之,朱守非课题组实现了Cu(I)催化环丙烯的开环硼化反应,拓展了卡宾对B-H键插入的反应类型,合成了一系列具有应用潜力的烯丙基硼烷类化合物。该反应具有广泛的底物适用性,且通过配体调控以及巧妙地利用分子内C-H插入的副反应,能够得到立体构型单一的3,3-二取代的烯丙基硼烷类化合物,为结构多样化的有机硼化合物的合成提供了有效的方法。
