催化不对称B-H键插入反应合成手性炔丙基硼
南开大学化学学院朱守非课题组发展了一种基于催化卡宾对B-H键的插入反应合成炔丙基硼的新方法。该方法以芳基炔基磺酰腙为卡宾前体,手性双铑配合物为催化剂,和稳定硼烷加合物发生不对称B-H键插入反应,以高收率和高对映选择性得到了新型的稳定手性炔丙基硼,具有条件温和、底物适用范围广、官能团耐受性好等特点,丰富了手性炔丙基硼的类型。该方法合成的手性炔丙基硼具有很好的应用潜力,可对映选择性保持地转化为手性联烯基硼酸酯、三氮唑硼化合物、高炔丙醇和炔丙醇等。该研究拓展了B-H键插入反应类型,丰富了手性有机硼化合物类型,为有机硼的合成应用和功能发现奠定了基础。该成果近期发表于ACS Catal. (2022, 12, 10654–10660),博士生邹慧娜是文章第一作者。
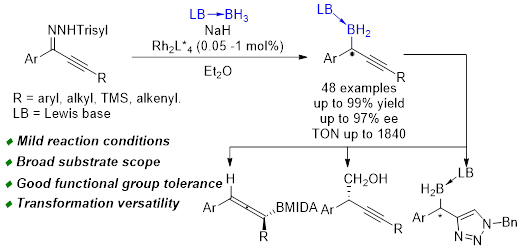
有机硼化合物在有机合成、医药、材料等众多领域都有广泛的应用,手性硼化合物高效构筑一直广受关注。虽然人们发展了大量合成方法学,实现了多种手性有机硼化合物的高效不对称合成,然而手性炔丙基硼化合物(硼与炔丙位手性中心直接相连)的合成至今仍然存在巨大挑战。这是由于在金属催化下,炔丙基金属中间体容易异构化得到联烯基金属中间体,因此在大多数催化反应中很难生成炔丙基硼。另一方面,炔丙基硼具有活泼的碳硼键,容易发生脱硼质子化、炔烃异构化等反应,稳定性较差。炔丙基硼化合物合成方法的匮乏和稳定性较差的问题一直阻碍其功能发现和实际应用,因此,发展高效高对映选择性的手性炔丙基硼化合物合成方法,合成稳定性较高的手性炔丙基硼,研究手性炔丙基硼的转化,具有重要价值。
朱守非课题组发展了一系列卡宾对硼氢键的插入反应,合成了多种结构新颖的有机硼试剂(Angew. Chem. Int. Ed. 2022, 61, e202203343; Chem. Sci. 2021, 12, 15790; Angew. Chem. Int. Ed. 2021, 60, 24214; CCS Chem. 2021, 3, 1721; J. Am. Chem. Soc. 2020, 142, 20924; J. Am. Chem. Soc. 2018, 140, 10663; ACS Catal. 2018, 8, 7351; J. Am. Chem. Soc. 2017, 139, 3784; J. Am. Chem. Soc. 2013, 135, 14094),作为这一方向的最新进展,近期他们使用易得的芳基炔基磺酰腙作为卡宾前体,在温和条件下,实现了手性双铑催化的不对称B-H键插入反应,可以高收率及高对映选择性获得稳定的手性炔丙基硼化合物。这是首例手性炔丙基硼化合物的高效、高对映选择性催化合成方法,具有底物范围广、操作简单、反应条件温和、官能团耐受性好等特点。该方法学拓展了催化卡宾对硼氢键插入反应,丰富了手性有机硼的种类,并初步揭示了手性炔丙基硼的转化规律,为其广泛应用奠定了基础。
该反应具有广泛的底物适用范围,三甲胺硼烷加合物、取代吡啶和硼烷的加合物、三烷基膦和硼烷的加合物以及氮杂环卡宾硼烷加合物都适用;炔基末端是芳基、烷基、烯基、三甲基硅基的芳基炔基磺酰腙也都能给出很好的结果(图1)。该反应有很好的官能团耐受性,醚基、硅基、酯基、氰基、硝基、三氟甲基、卤素、苯并呋喃基、苯并吲哚基、噻吩基都能耐受。
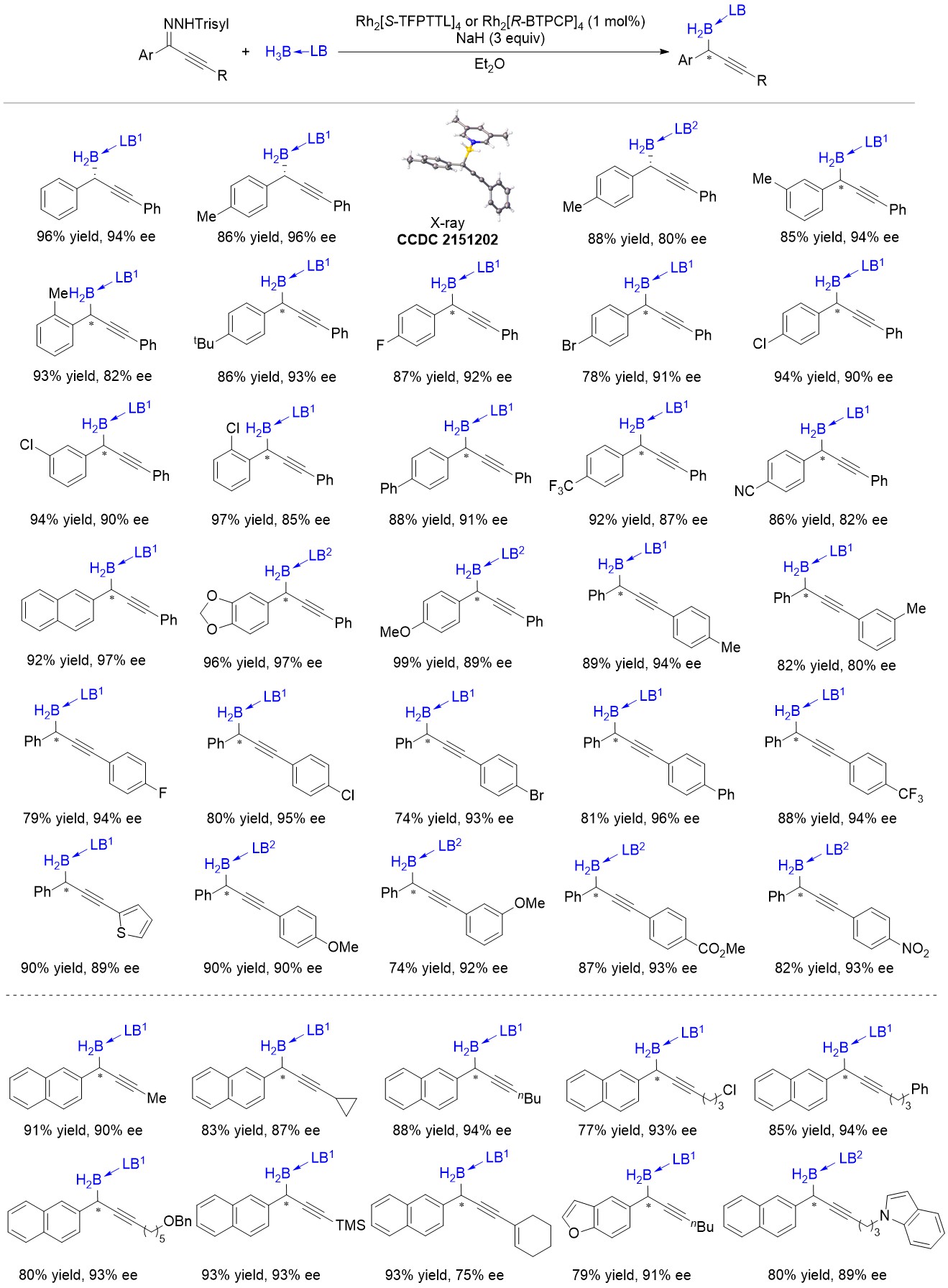
图1 底物适用范围:炔基末端为芳基、烷基、烯基、硅基的芳基炔基磺酰腙
(LB1 = 3,5-Me2Py; LB2 = NMe3)
该反应具有较好的应用潜力。反应可以放大到克级规模,催化剂用量可降低至0.05 mol%,结果能很好的保持(图2A)。所得手性炔丙基硼产物能进行多种转化(图2B),包括经过1,3-同面硼迁移异构化制备手性联烯基硼酸酯;与醛加成得到手性高炔丙醇化合物;经“点击”反应合成手性三氮唑有机硼化合物;氧化生成手性炔丙醇等。手性炔丙基硼、联烯基硼、双(杂)芳基硼、高炔丙醇、炔丙醇化合物均为重要的有机合成砌块,可作为天然产物及生物活性分子的重要合成子(图2C)。

图2 合成应用展示
为了探究反应机理,研究者开展了一系列控制实验(图3)。同位素标记实验表明,硼烷的B和H都加成到卡宾的碳上(图3A)。竞争同位素实验和平行同位素实验中,观察到明显的二级同位素效应,这表明B-H键插入过程不是该反应的决速步(图3B, 3C)。此外,研究者发现α-芳基对位带有取代基产物的ln(er)与Hammett常数Δσp(R-H)呈线性关系(图3D),这表明反应最可能经历了缺电子类型的Fisher铑卡宾中间体,有可能是芳环为满足缺电子的卡宾碳的电性需求,采取和Rh=C双键正交或共平面的构象所致。
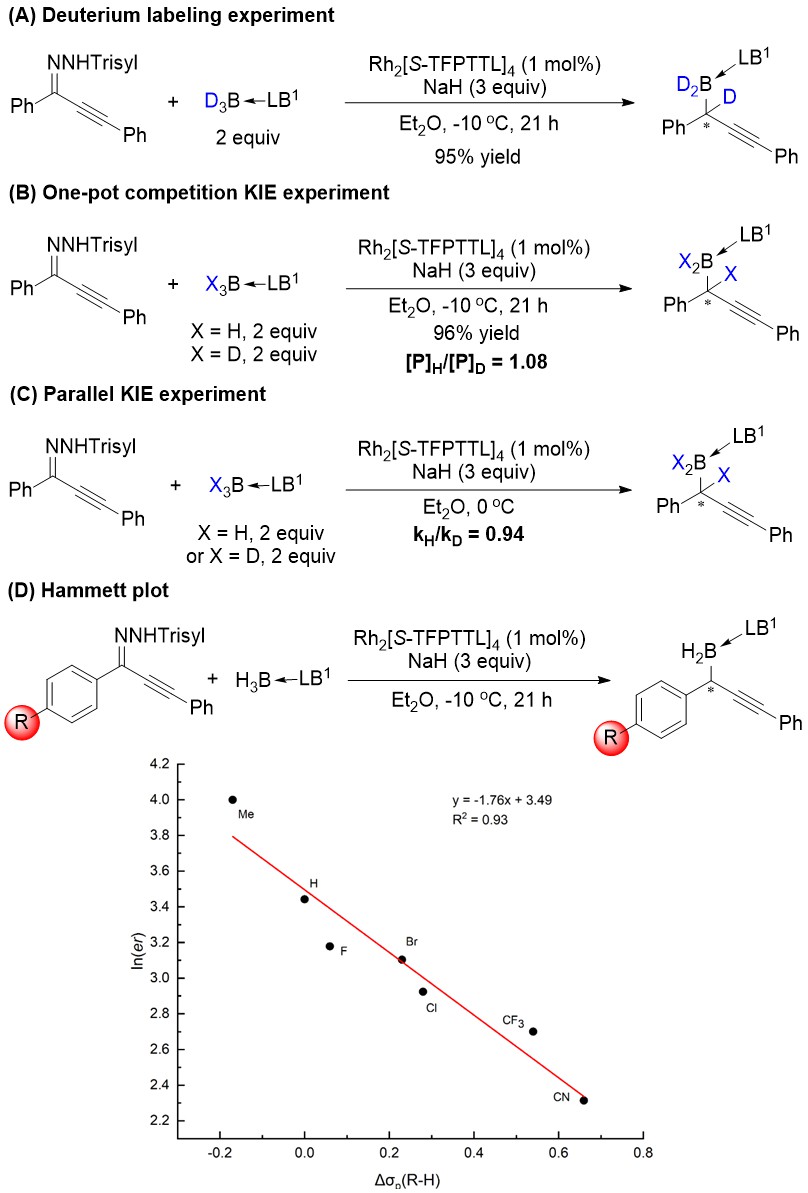
图3 机理研究实验
基于机理实验并参考其它B-H键插入反应的机理,研究者提出了可能的催化循环(图4)。首先,芳基炔基磺酰腙在碱作用下分解产生非稳定的芳基炔基重氮,随后铑催化剂分解重氮经历Int-I和TS-I得到铑卡宾Int-II,Int-II迅速与硼烷加合物的B-H键经历三元环过渡态TS-II得到产物,完成催化循环。
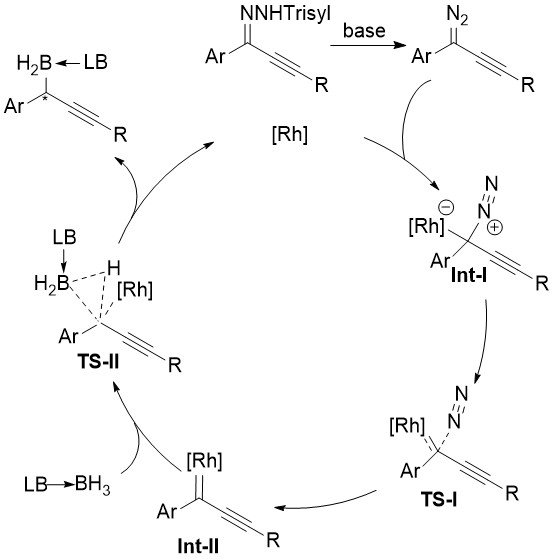
图4 建议机理
总之,本研究以易得的芳基炔基磺酰腙为卡宾前体,实现了手性铑催化芳基炔基卡宾对B-H键的不对称插入反应,以高收率和高对映选择性得到了稳定的手性炔丙基硼化合物,为手性炔丙基硼化合物的合成提供了为数不多的有效途径。该反应条件温和,产物稳定性好,底物范围广,官能团耐受性好,转化数最高可达1840,为手性炔丙基硼化合物的合成提供了实用的方法。此外,手性炔丙基硼化合物可进行丰富的转化,方便地合成手性联烯基硼酸酯,手性高炔丙醇,手性芳基三氮唑硼化合物,手性炔丙醇等重要合成砌块,展现出很好的应用前景。
