Research: Enantioselective α‑Boryl Carbene Transformations
α-硼基卡宾的不对称转移反应
卡宾是有机化学中重要的中间体,具有丰富的反应性,涉及卡宾的有机反应在药物化学、农药化学以及材料化学中广泛应用。可用于催化反应,特别是不对称催化反应的新型卡宾的发现是卡宾化学发展的核心推动力,不仅会丰富卡宾转移产物的类型,还为新型卡宾转移反应的发现奠定基础。过去的几十年中,过渡金属催化主族元素(如碳、硅、磷、硫等)取代卡宾的不对称转移反应已经被广泛用于多种碳-碳或碳-杂原子键的构筑。与这些元素的官能团相比,硼酸或硼酸酯基团由于其Lewis酸性、与醇或胺等亲核试剂可逆结合的倾向以及形成氢键的能力而展示出独特的化学以及生物特性,在合成化学、材料科学、化学传感以及药物发现中被广泛应用。可以预见,结合了卡宾与硼基团的α-硼基卡宾在有机硼合成中将有着独特的应用潜力。然而α-硼基卡宾的研究却非常有限,这主要是由于α-硼基的强Lewis酸性使得一般重氮前体难以稳定存在,目前仅有基于大位阻α-硼氮杂环重氮或α-四配位硼基磺酰腙取代的两类硼基卡宾被用于过渡金属催化的转移反应。整体而言,目前α-硼基卡宾的生成方式非常有限,结构类型单一,且其催化不对称转移反应还未见报道,极大地限制了其应用潜力。
南开大学朱守非课题组一直致力于拓展卡宾化学在有机硼构筑方面的应用,发展了系列不同官能团取代卡宾以及不饱和卡宾的B-H键插入反应(J. Am. Chem. Soc. 2013, 135, 14094; J. Am. Chem. Soc. 2017, 139, 3784; ACS Catal. 2018, 8, 7351; J. Am. Chem. Soc. 2018, 140, 10663; J. Am. Chem. Soc. 2020, 142, 20924; CCS Chem. 2021, 3, 1721; Angew. Chem. Int. Ed. 2021, 60, 24214; Chin. J. Chem. 2021, 39, 3211; Angew. Chem. Int. Ed. 2022, 61, e202203343; ACS Catal. 2022, 12, 10654; Chem. Sci. 2023, 14, 9186; Sci. Adv. 2023, 9, eadj2486.)。最近,该课题组发展了一类全新的1-硼基环丙烯的卡宾前体,其能够在铜催化下发生选择性开环生成α-烯基-α-硼基卡宾,进而发生一系列不对称卡宾转移反应,包括B-H键插入、Si-H键插入、环丙烷化反应以及环丙烷化/Cope重排反应(图1)。本研究发展的α-硼基卡宾前体易于合成、易于修饰改造、结构多样性好、适合催化不对称转化,能用于多种不对称卡宾转移反应,不仅为新型手性含硼化合物的合成提供了有效方法,还深化了对α-硼基卡宾反应性的理解。相关成果发表在J. Am. Chem. Soc.(https://doi.org/10.1021/jacs.3c14766)上。
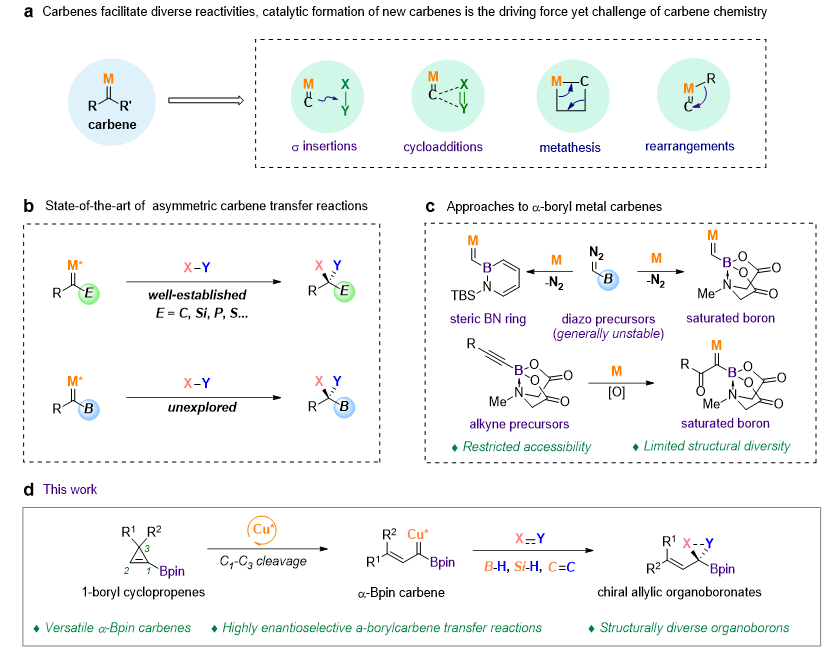
图1. α-硼基卡宾的研究进展
手性双噁唑啉配体L1与离子性一价铜盐Cu(MeCN)4PF6形成的配合物能够高效、高对映选择性地催化1-硼基环丙烯衍生α-硼基卡宾的不对称B-H键、Si-H键插入反应,环丙烷化反应以及环丙烷化/Cope重排反应,并展现出了良好的官能团耐受性,得到了系列结构新颖的手性烯丙基偕二硼、手性烯丙基偕硅硼、手性环丙基硼以及手性环庚二烯基硼类化合物(图2,图3)。
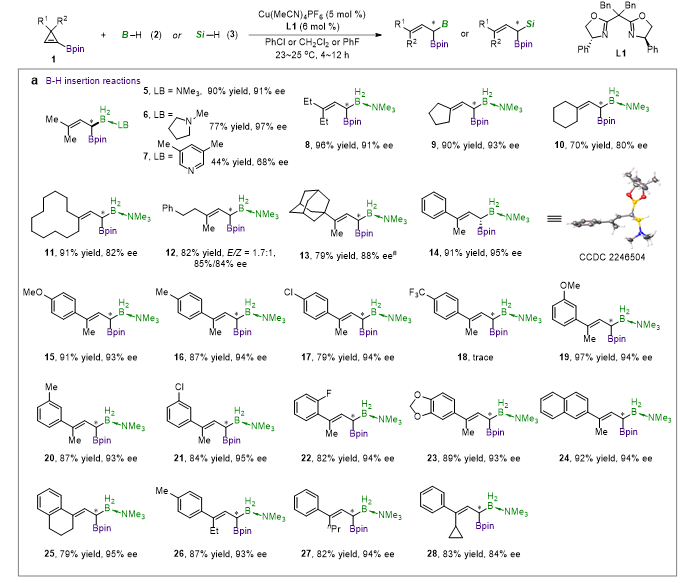
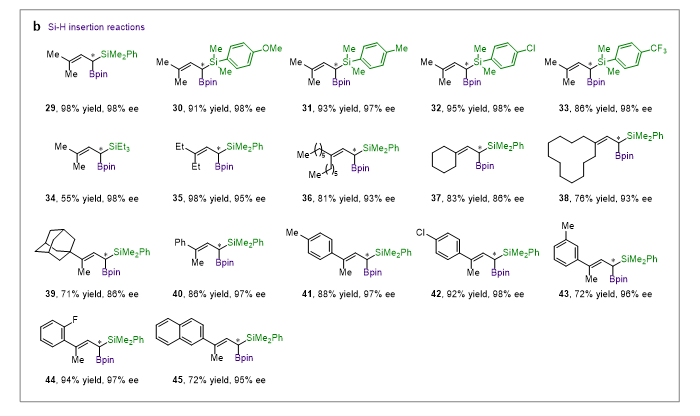
图2. 铜催化α-硼基的不对称B-H/Si-H键插入反应
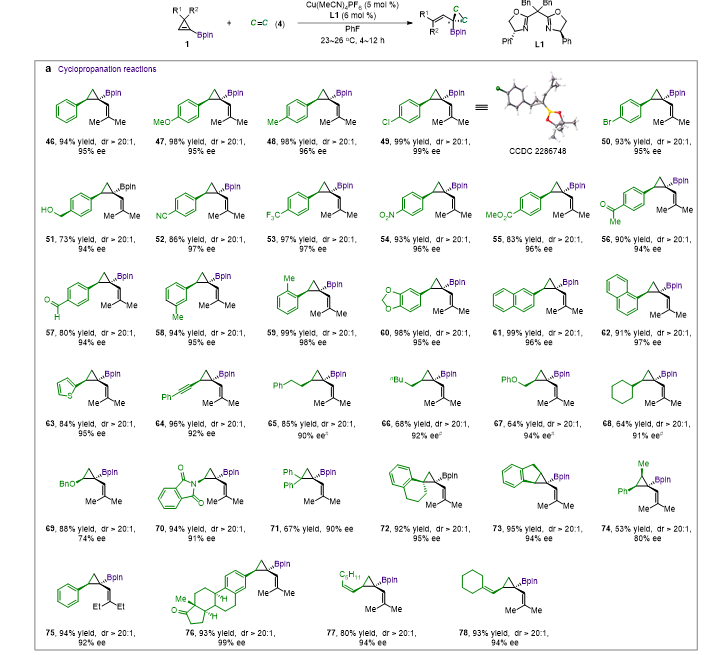

图3. 铜催化α-硼基卡宾的不对称环丙烷化以及环丙烷化/Cope重排反应
这些结构新颖的手性有机硼化合物具有丰富的转化潜力,不仅能够发生Bpin基团的转化,如氧化为醇、同系化增碳等,还能通过多步转化合成结构更为复杂的多手性中心分子(图4)。

图4. 产物的转化
在B-H键插入反应的氘代实验中,硼和氘加成到同一个碳上,说明反应可能经历了卡宾插入的过程(图5a, I)。原位红外测定的B-H键插入反应的动力学级数表明反应对环丙烯底物1a、铜催化剂为一级,对硼烷加合物为零级(图5a, II),说明环丙烯开环可能是反应的决速步,这与DFT计算结果相符合。对1-硼基环丙烯1a中C1和C2的Hirshfeld电荷分布计算结果表明,硼基的空p轨道对烯键有明显的极化作用,使得与其相连的C1具有更多负电荷,更容易被缺电子的Cu催化剂进攻(图5b)。而在底物与催化剂形成的配位中间体Int-Cu-S中,Cu-C1的键长比Cu-C2的键长稍短,而C1-C3键较C2-C3键更长,表明Cu中心确实更倾向于进攻C1端从而活化C1-C3键。另一方面,对两种开环方式的过渡态分析表明,在硼端开环的过渡态RO-TS-B的能量确实比氢端开环过渡态RO-TS-H的能量要低,这可能是由于,在RO-TS-B中硼基的空p轨道与卡宾碳的缺电子p轨道近乎垂直(76.4o),避免了共轭,由于硼的电负性比碳低,因而主要表现出σ-给电子效应,有利于稳定过渡态;而在RO-TS-H中,硼基的空p轨道与卡宾碳缺电子p轨道处于近乎平行的状态(19.3o),两者可通过C1-C2的烯键共轭,稳定性较差,因而能量更高。此外,通过对三种产物绝对构型的分析,他们发现卡宾捕获试剂(硼烷、硅烷、烯烃)都是从卡宾的Re面进攻的,这表明三类反应可能有共通的手性模型(图5c, I)。通过对铜卡宾位阻图的分析,可以发现卡宾的东北(NE)与西南(SW)部分被手性双噁唑啉配体的两个芳基所屏蔽,而环丙烯形成的卡宾部分就坐落在由西北(NW)到东南(SE)的沟壑之中。由于硼基的空2p轨道要尽量避免与卡宾碳的p轨道共轭,因此Bpin基团采取与卡宾平面相垂直的取向,屏蔽了整个南部区域。因此,卡宾捕获试剂从位阻最小的西北处进攻能量最低(图5c, IV),得到了Re面进攻的产物(图5c, II, III)。综合来看,硼基有两个作用,一方面极化了烯基,诱导了环丙烯开环的化学选择性;另一方面,硼基与卡宾平面近乎垂直的构象增大了卡宾的位阻和刚性,使催化剂的手性空腔能够有效识别反应的手性面,实现了不同卡宾转移反应的手性控制。
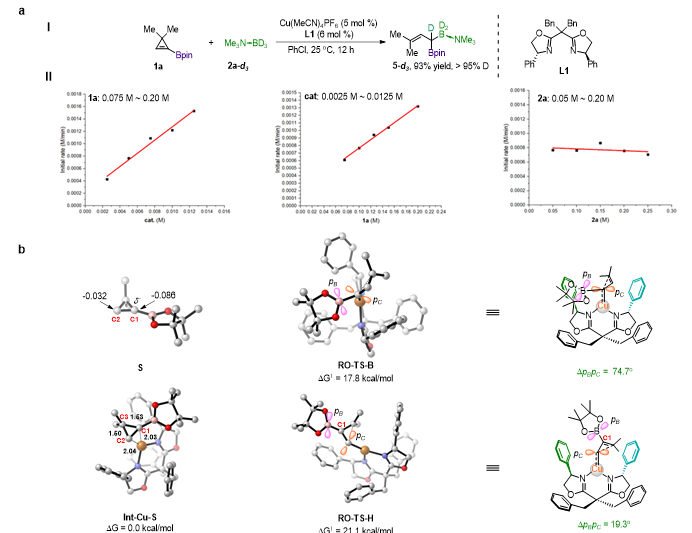

图5. α-硼基卡宾不对称转移反应的机理研究
最后,他们通过计算分析比较了Bpin取代、COOMe取代以及H取代三类卡宾的性质(图6)。电荷分解分析(CDA)表明,Bpin取代卡宾中的卡宾残基对金属铜中心转移的电荷密度(0.181)最小,而且其LUMO能量(-5.391)相较于其它两类卡宾也更高,这表明α-硼基卡宾可能是亲电性较弱的一类卡宾。Bpin取代卡宾的LUMO能量以及亲电指数w与H取代卡宾的类似,这表明这两类卡宾在电子性质上较为相似,因而α-烯基-α-硼基卡宾应该是一类给体型卡宾。
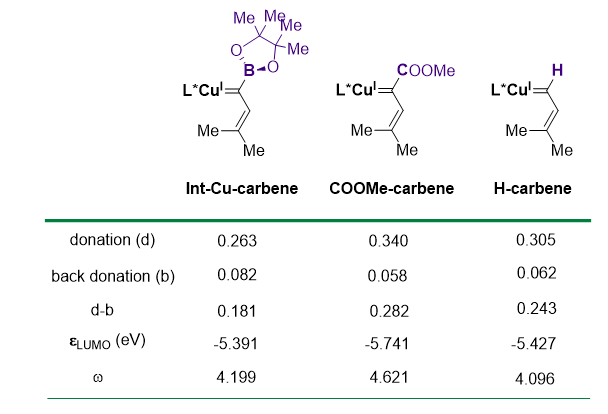
图6.不同卡宾的性质比较
总之,朱守非课题组报道了1-硼基环丙烯这类全新的α-硼基卡宾前体,其在手性铜催化下能够发生选择性开环生成α-硼基卡宾,并发生系列不对称转移反应之中,生成结构独特、类型新颖、转化丰富的手性有机硼化合物,包括手性烯丙基偕二硼、手性烯丙基偕硅硼、手性环丙基硼以及手性环庚二烯基硼等。机理研究表明反应的决速步应该在环丙烯开环这一步,且硼基团对反应化学选择性以及对映选择性的控制有着重要作用。该工作填补了α-硼基卡宾不对称转移反应研究的空白,深化了对α-硼基卡宾的性质理解以及其转移过程中的手性控制规律认知,为结构新颖的有机硼的高效合成提供了新的思路。
论文信息:Ming-Yao Huang(黄明耀), Jia-Bao Zhao(赵嘉宝), Cheng-Da Zhang(张成达), Yuan-Jun Zhou(周源峻), Zhan-Sheng Lu(路战胜), Shou-Fei Zhu*(朱守非), Enantioselective α-boryl carbene transformations, J. Am. Chem. Soc. 2024, 146, ja-2023-14766s. https://doi.org/10.1021/jacs.3c14766
