α-硅基卡宾作为一种官能化卡宾,其不对称转移反应能够高效构筑α-手性有机硅化合物。尽管近年来α-碳卡宾的不对称插入反应已经发展成为构筑碳-碳键或碳-杂原子键的重要方法,与之相比,由于卡宾前体类型以及催化策略的匮乏,α-硅基卡宾的不对称转移反应研究却非常有限,且多集中于环丙烷化反应,高对映选择性的插入反应未见报道。
近年来,南开大学化学学院朱守非课题组发展了一系列卡宾对硼氢键的插入反应,合成了多种结构新颖的有机硼试剂(Chem. Sci. 2021, 12, 15790; Angew. Chem. Int. Ed. 2021, 60, 24214; CCS Chem. 2021, 3, 1721; J. Am. Chem. Soc. 2020, 142, 20924; J. Am. Chem. Soc. 2018, 140, 10663; ACS Catal. 2018, 8, 7351; J. Am. Chem. Soc. 2017, 139, 3784; J. Am. Chem. Soc. 2013, 135, 14094)。最近,该课题组报道了铜催化下1-硅基环丙烯高区域、立体以及对映选择性的开环/B–H键插入反应,制备一系列结构独特、构型单一的E式手性γ,γ-双取代烯丙基偕硅硼化合物(图1)。该反应的立体化学决定步骤是α-硅基卡宾对B–H键的插入反应。成果发表在Angew. Chem. Int. Ed.(https://doi.org/10.1002/anie.202203343)。
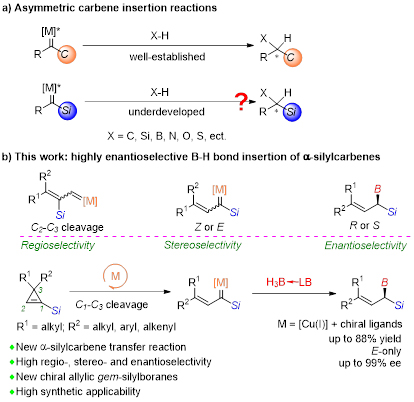
图 1. (a)不对称卡宾插入反应;(b)α-硅基卡宾的高对映选择性B-H插入反应
(图片来源:Angew. Chem. Int. Ed)
以铜/手性双噁唑啉络合物为催化剂,在温和条件下,多种3,3-双取代的环丙烯底物均能够以中等或以上的收率(40-88%)以及优异的对映选择性(87-99%)得到E式构型的手性偕硅硼产物(图2)。其中,3,3-双烷基取代底物的副产物主要是共轭二烯基硅5',而3-芳基-3-烷基取代底物的副产物则为1-硅基茚5''。
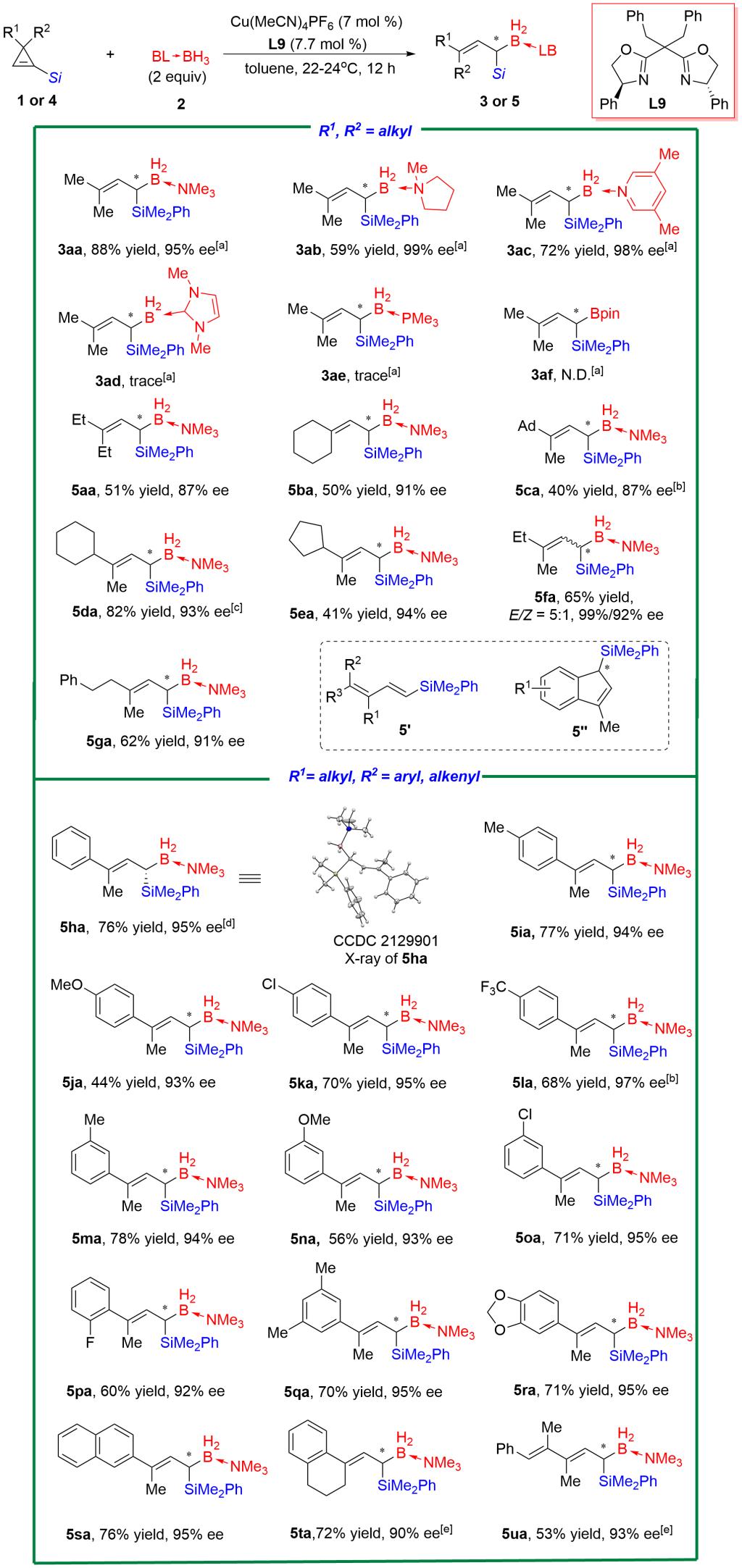
图 2. 底物拓展 (图片来源:Angew. Chem. Int. Ed)
所得手性烯丙基偕硅硼产物能发生丰富的转化(图3)。除了常规的氧化,变成硼酸酯外,其与亚胺或醛能发生α-或γ-烯丙基硼化反应分别生成高烯丙基胺9或高烯丙醇10,10经环氧化开环能得到带连续4个手性中心的四氢呋喃结构11。此外,将10做成缩醛12后在四氯化钛的作用下能发生重排反应生成手性的异色满衍生物13。这表明此类γ,γ-双取代烯丙基偕硅硼试剂在多手性中心复杂分子的构建中有着很好的应用潜力。
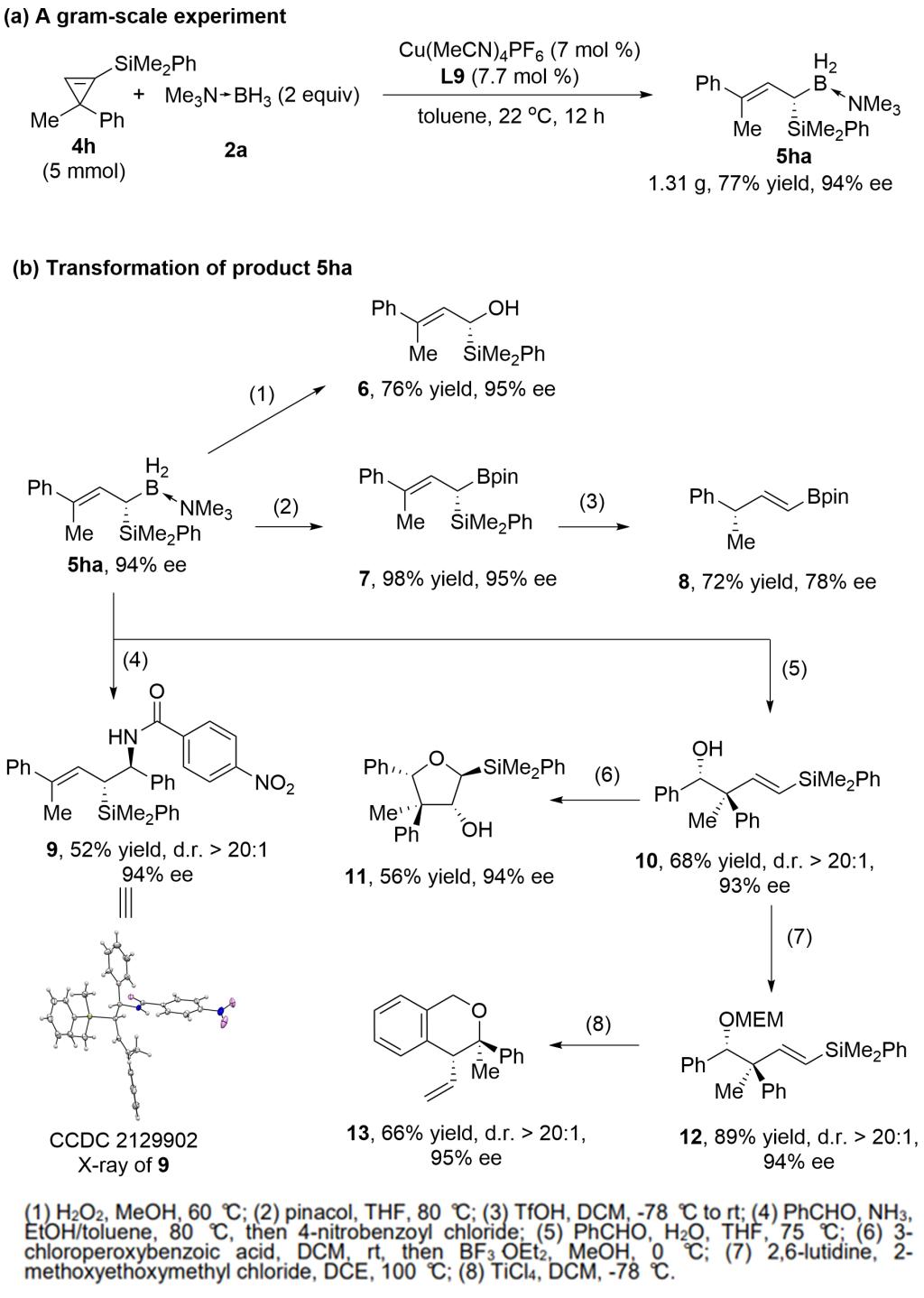
图 3. 克级规模实验及产物转化(图片来源:Angew. Chem. Int. Ed)
作者对反应机理进行探究。动力学级数表明反应对催化剂、环丙烯为一级、硼烷为零级,环丙烯开环为决速步。反应展现出明显的正非线性效应,说明反应的活性铜催化剂可能具有双核乃至多核结构。
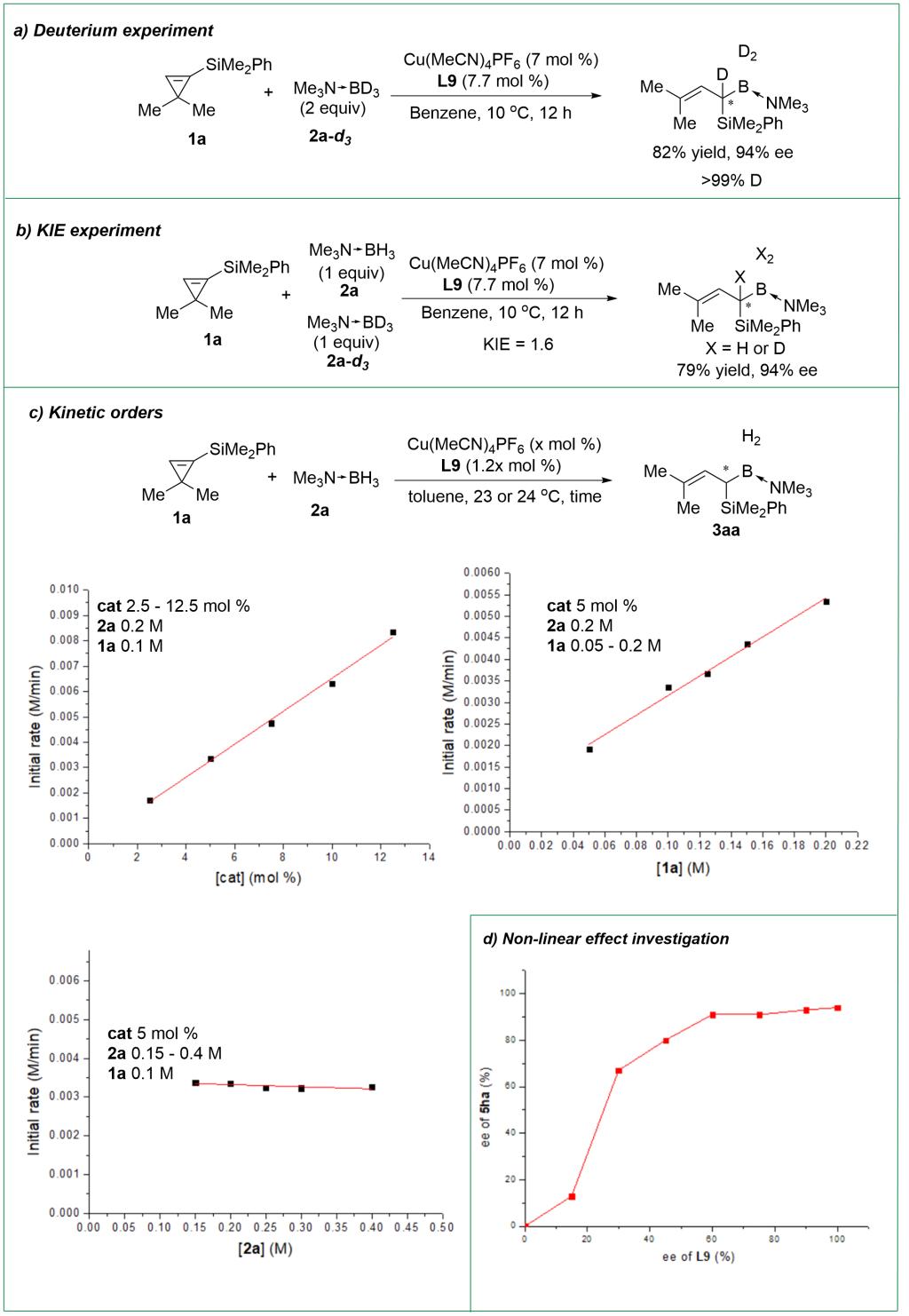
图 4. 机理实验(图片来源:Angew. Chem. Int. Ed)
基于这些机理实验以及观察到的副产物,作者认为硅基空3d轨道和环丙烯的d-π共轭极化了环丙烯的烯键,与硅基相连的C1具有更多的负电荷,更容易被铜催化剂进攻进而发生C1–C3键断裂生成E式或Z式的金属卡宾。E式卡宾与硼烷发生不对称B–H键插入生成偕硅硼产物。而Z式卡宾由于位阻较大,难以发生分子间的B–H键插入而只能发生分子内的副反应:1)当R为烷基时,发生分子内的1,4-氢迁移反应得到共轭二烯基硅副产物5';2)当R为芳基时,发生分子内的亲电环化反应得到形式上C–H插入的1-硅基茚副产物5''。这样,Z式卡宾通过分子内副反应被完全消耗,最终的插入产物只有E式一种构型。

图 5. 反应机理(图片来源:Angew. Chem. Int. Ed)
总之,朱守非课题组发展的1-硅基环丙烯的高区域、立体以及对映选择性的开环/硼氢键插入反应代表了首例的α-硅基卡宾的高对映选择性插入反应,丰富了手性偕双金属试剂的类型与获得途径,也为α-硅基卡宾的不对称转移反应提供了新的思路。
该工作近期发表在 Angew. Chem. Int. Ed.上,第一作者为南开大学博士研究生黄明耀,通讯作者为朱守非教授。
