铁催化内炔氢铝化反应
南开大学化学学院朱守非课题组报道了首例铁催化炔烃的氢铝化反应,使用结构明确的2,9-二芳基-1,10-菲罗啉和铁的配合物催化剂,以常见的商品化的DIBAL-H作为铝试剂,实现了芳基烷基取代内炔、烯基烷基取代内炔、胺基导向炔丙胺和双芳基内炔的高效、高立体选择性和高区域选择性的氢铝化反应,制备了结构多样性丰富的烯基铝试剂,并用于药物中间体的合成。和文献报道的其它金属催化剂相比,本文发展的铁催化剂具有以下优点:底物范围广、官能团耐受性好、选择性高、条件温和等,具有很好的应用潜力。该反应利用C-Al键易于转化的优势,为高选择性地合成多种三取代烯烃提供了高效的合成方法。相关成果近期发表于Chem Sci. (2022, 13, DOI: 10.1039/D2SC02160A),博士生李文涛是文章第一作者。

图1 铁催化内炔的氢铝化反应
有机铝基于地壳中含量最高的金属元素,稳定性较高,可以发生多种转化,是一类重要的金属有机试剂,广泛应用于合成中。炔烃的氢铝化反应可以从简单易得的铝试剂合成更有用的烯基铝,具有重要的应用价值。虽然一些活泼的炔烃和活泼的铝试剂在加热下能直接发生氢铝化反应,但是反应通常存在较多副产物,且产物的选择性由底物控制,无法自由调控。过渡金属催化的炔烃氢铝化则可以方便地通过改变配体调控反应的选择性,因此在合成上有明显优势。虽然过渡金属催化的端炔氢铝化已经得到很好的结果,过渡金属催化的高选择性内炔氢铝化反应成功的例子很少,而且存在催化剂类型少、底物单一、选择性不理想等问题。因此,发展新催化剂,实现商业可得的铝试剂与多种内炔的高选择性氢铝化,并将该反应应用于功能分子的合成,具有重要研究价值。
南开大学化学学院朱守非课题组一直致力于铁催化反应的研究(J. Am. Chem. Soc. 2022, 144, 515; ACS Catal. 2022, 12, 2581; Chem. Sci. 2022, 13, 2721; J. Am. Chem. Soc. 2020, 142, 16894; J. Am. Chem. Soc. 2019, 141, 4579; Nat. Commun. 2018, 9, 221; J. Am. Chem. Soc. 2017, 139, 7697; Angew. Chem. Int. Ed. 2014, 53, 13188),作为这一方向的最新进展,近期他们报道了首例铁催化炔烃的氢铝化反应。研究表明,2,9-二芳基-1,10-菲罗啉配体和铁的配合物能够催化商业可得的常用铝试剂二异丁基氢化铝(DIBAL-H)和多种内炔的氢铝化反应,给出单一的顺式加成产物和很高的区域选择性(图1)。该反应为烯基铝试剂的合成提供了有效方法,结合烯基铝产物的丰富化学转化,可用于官能团化或非官能团化三取代烯烃的高效合成。本文所发展的铁催化内炔氢铝化反应表现出以下优势:1)在相同条件下,铁催化剂在化学选择性和区域选择性方面明显优于文献报道的用于氢铝化的催化剂。2)铁催化剂表现出良好的官能团耐受性,可耐受烯基、卤素、羟基、胺基、缩醛等官能团。3)实现了胺基导向的多种内炔的高选择性氢铝化,首次实现了芳基烷基取代炔烃的烷基一端铝化,其中炔丙胺衍生物胺基β-铝化反应还被成功用于药物分子合成。4)首次实现了共轭烯炔的催化氢铝化,以很高的收率和选择性给出共轭二烯基铝。
研究者选择苯基正丁基乙炔作为模型底物,使用商品化的DIBAL-H (1M in hexane)作为铝氢试剂,开展了系统的条件实验,发现已报道的炔烃氢铝化反应催化体系(Ti, Zr, Ni)在本反应中均未得到理想结果;单膦配体、双膦配体、氮杂环配体、双齿氮配体,三齿氮配体和铁的配合物均不能给出较好的活性和选择性。该课题组前期发展的2,9-双芳基菲啰啉配体和铁的配合物催化剂C1(其中Ar = 菲基或蒽基)能给出很高的收率、区域选择性和立体选择性。
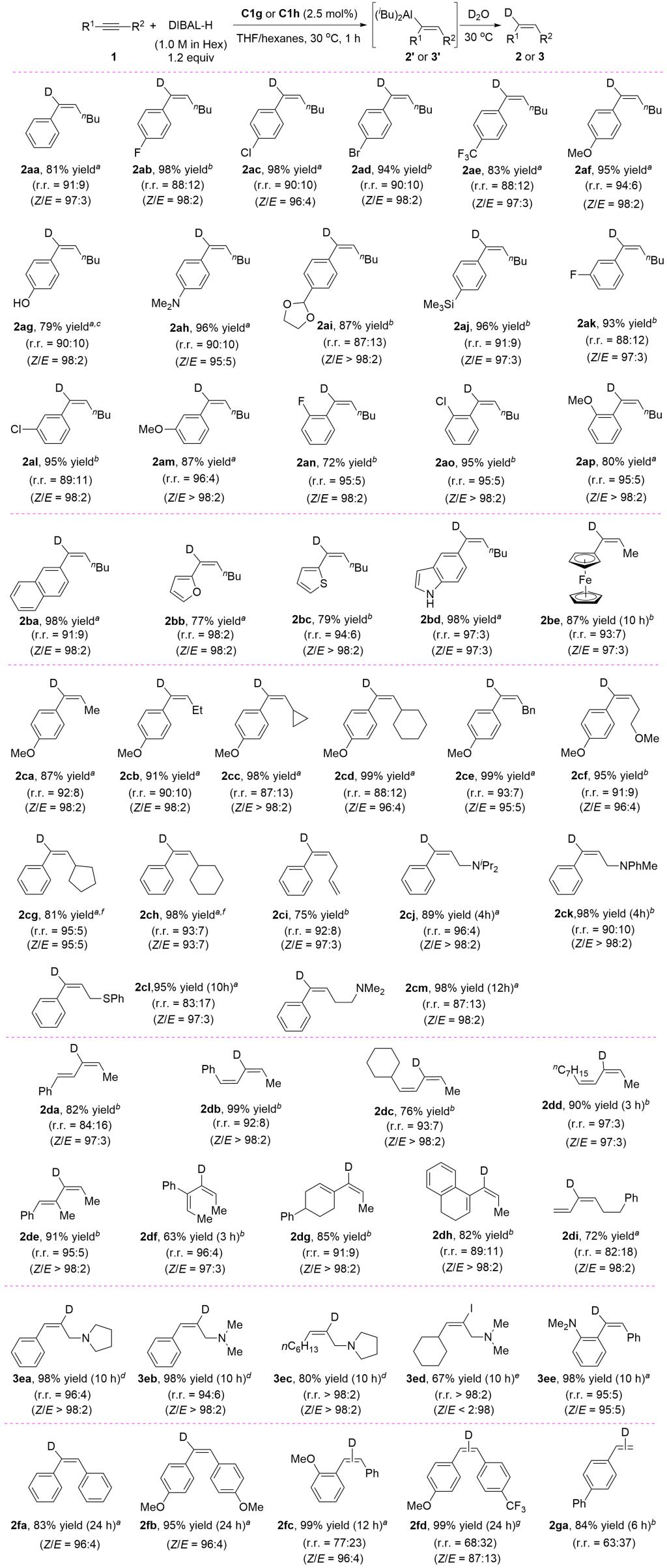
图2 底物适用范围
该反应具有较为广泛的底物适用范围(图2),对于芳基烷基炔烃、烯基烷基炔烃、双芳基炔烃都适用,能够以很好的区域选择性(r.r. = 87:13 – 96:4)和立体选择性(Z/E = 93:7 – >98:2)得到铝顺式加成到内炔靠近芳基一侧的产物。该反应有很好的官能团耐受性,卤素、三氟甲基、醚基、胺基、缩醛基、硅基、呋喃基、噻吩基、吲哚基、二茂铁、烯基等都能耐受。对于芳基烷基内炔,烷基部分的改变对反应性和区域选择性的影响不明显。铁催化剂能催化共轭烯炔的氢铝化,得到一系列新型共轭二烯基铝。利用烷基胺作为导向基,我们首次实现了双烷基内炔的高区域选择性的氢铝化,铝加成到内炔靠近胺基一侧。这一胺基导向策略也能用于非对称的双芳基内炔。
本文报道的铁催化剂在多类代表性的内炔氢铝化反应中,相比已报道的炔烃氢铝化反应催化体系(Ti, Zr, Ni)和非催化体系,在反应活性和选择性上表现出明显的优势(图3)。


图3 铁催化剂与文献中催化氢铝化反应体系的对比([Fe] = C1, [Ti] = Cp2TiCl2, [Zr] = Cp2ZrCl2, [Ni1] = Ni(PPh3)2Cl2, [Ni2] = Ni(dppp)Cl2. ND = Not detected. a Heated in hexanes at 50 ℃, 12 h.)
研究者通过核磁表征了四氢呋喃配位的烯基铝以及DMAP配位的烯基铝产物的结构(图4a)。烯基铝产物能通过取代、偶联、加成等转化,合成多种三取代烯烃(图4b)。炔丙胺底物经过氢铝化和偶联反应,可一锅法合成药物分子的关键中间体(图4c)。内炔通过氢铝化和加成反应,能得到在生物活性分子合成中有重要用途的三取代烯酰胺(图4d)。相比文献中的合成方法,通过本文发展的方法合成烯酰胺和烯基碘更加简洁高效(图5)。
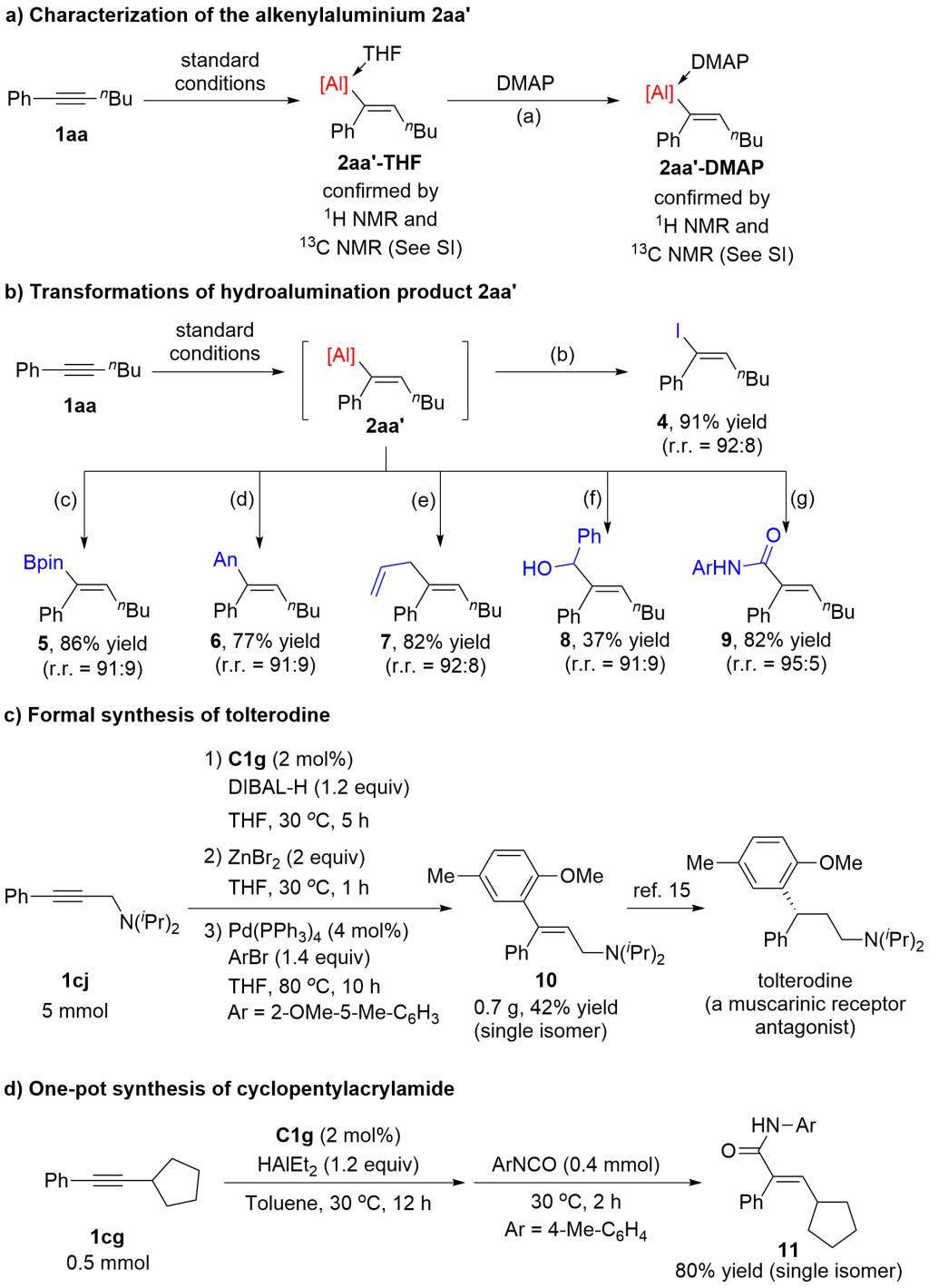
图4 产物表征和应用转化
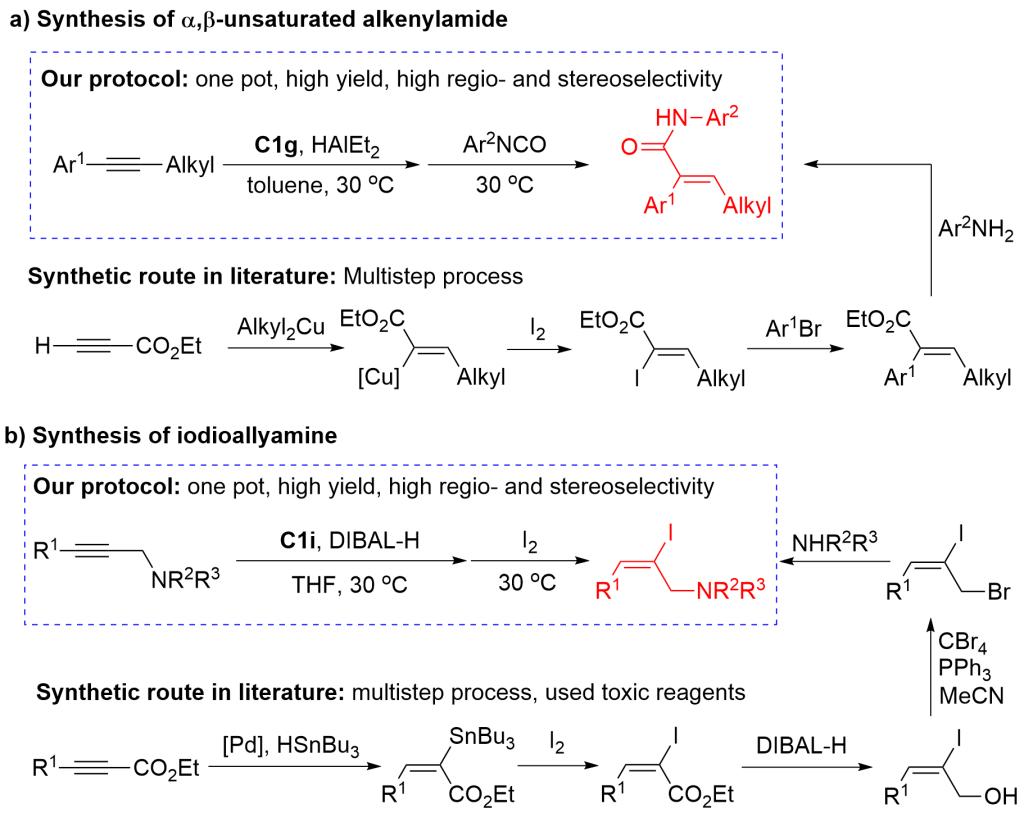
图5 铁催化内炔氢铝化在合成官能团化三取代烯烃中的优势
研究者通过一系列控制实验探究反应的机理(图6)。氘代实验表明产物的氢是来自铝氢试剂的铝氢,而非铝氢试剂的烷基(图6a)。不同的双烷基铝氢试剂对反应的选择性没有明显影响,说明铝试剂很可能没有参与到反应的区域决定步(图6b和6c)。竞争动力学实验所得的显著反常的KIE效应,表明碳氢键的成键很可能是一个快速可逆的步骤(图6d)。内炔底物交叉实验表明反应整体是不可逆的(图6e)。自由基捕获试剂不会影响反应的结果,表明反应很可能没有经过自由基的机理(图6f)。
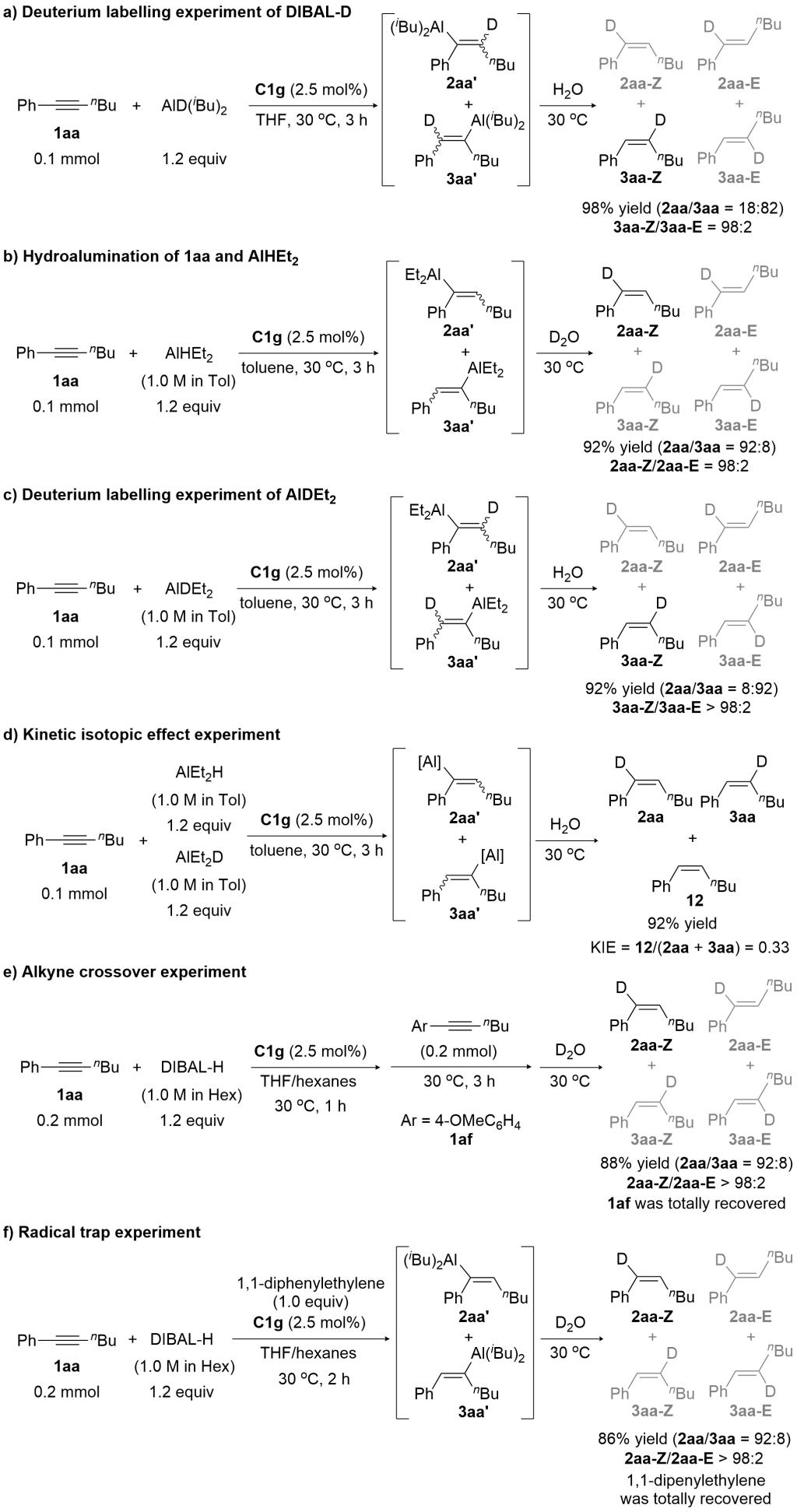
图6 控制实验
在上述实验结果的基础上,结合其它铁催化负氢转移反应的机理,研究者建议了如图7所示的催化循环。首先,铁(II)催化剂前体和DIBAL-H发生配体交换交换,生成Fe(II)-H活性物种,该物种与内炔发生迁移插入,进而和铝氢试剂转金属化生成烯基铝,完成催化循环。研究者认为铁催化剂的邻菲罗啉配体和芳香内炔的芳基可能存在显著的π-π堆积作用,使氢主要加成到内炔靠近烷基的一侧。含配位性胺基的内炔可能由于胺基和铁催化剂配位,导向铝加成到内炔靠近胺基一侧,从而表现出独特的区域选择性。需要指出的是,我们目前不能排除经由Fe(0)-Fe(II)的催化循环等可能途径,更深入的机理研究仍在进行。
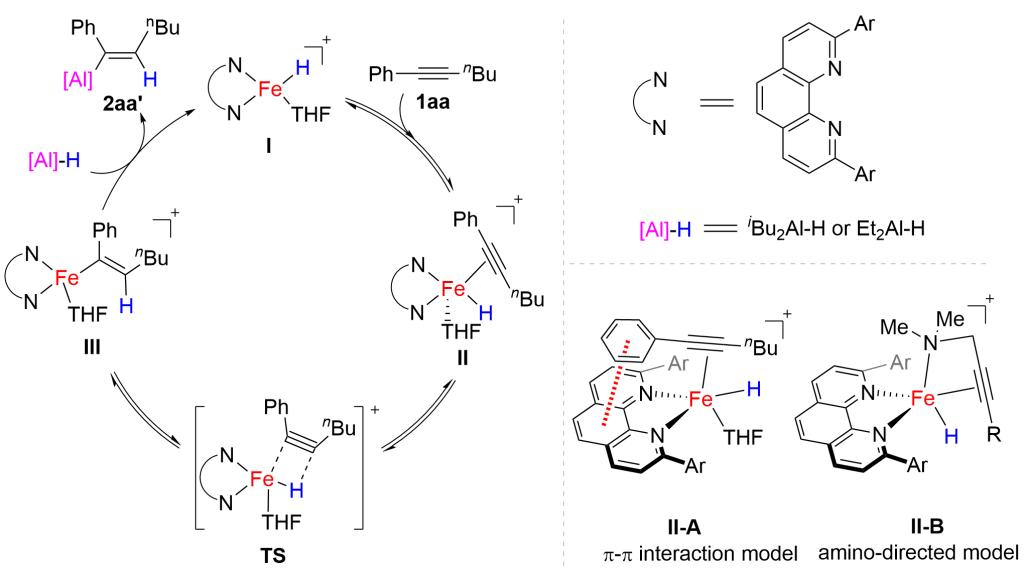
图7 建议机理
总之,本文使用双齿菲罗啉和铁的配合物作为催化剂,实现了内炔高活性、高区域选择性和高立体选择性的氢铝化反应,得到顺式加成的烯基铝产物。本文发展的铁催化剂和文献中已知催化剂相比,表现出不同的反应性和选择性,官能团耐受性优异,底物适用范围广,还首次实现了胺基导向的氢铝化反应。该方法为结构和官能团多样性有机铝试剂的合成提供了新方法。产物的C-Al键可以通过取代、偶联、加成等反应高效合成多种官能化的三取代烯烃。该研究拓展了铁催化反应类型,展示了铁催化剂不可替代的反应性,丰富了有机铝的合成方法。
