Research: Additive-Controlled Regiodivergent Catalytic Alkyne Hydrosilylation Reactions
添加剂调控的区域发散性钴催化炔烃硅氢化反应
催化反应的选择性调节是有机合成的研究重点。反应选择性(包括化学选择性、区域选择性和立体选择性等)的控制主要由催化剂和底物的立体电子性质决定。然而,许多研究表明,添加剂也会显著影响反应选择性。在某些情况下,不同的添加剂可以给出不同选择性的产物。这就意味着,添加剂为反应选择性调控提供了一种潜在有效手段,深刻认识添加剂效应的机理,对于反应设计具有重要价值。然而,目前文献中缺少对添加剂效应的系统研究,对于添加剂的作用机制的理解还非常有限,亟需深化。
近年来,南开大学朱守非课题组一直致力于开壳层催化剂促进的有机合成反应研究,发展了系列基于邻菲罗啉和环丙烷骨架的配体及其铁和钴配合物催化剂,实现了不饱和烃的氢元素化和碳锌化以及碳碳偶联反应,发现了开壳层铁和钴催化剂在这些反应中表现出的不可替代性与催化剂自旋态密切相关,进而提出“自旋响应催化”概念,以期将电子自旋发展成催化反应调控的新维度(Nature Catalysis 2025, 8, 178; Natl. Sci. Rev. 2024, 11, nwad324; J. Am. Chem. Soc. 2024, 146, 5051; 2022, 144, 515; 2020, 142, 16894; 2019, 141, 4579; Angew. Chem. Int. Ed. 2024, 63, e202402044; 2023, 62, e202315473; 2022, 61, e202208473; Nat. Commun. 2018, 9, 221; ACS Catal. 2022, 12, 2581; Chem. Sci. 2022, 13, 2721; 2022, 13, 7873; Chin. J. Chem. 2023, 41, 3547; Chem. Eur. J. 2024, 30, e202403437)。本工作中,作者报道了环丙烷骨架双膦配体Co配合物催化的非对称内炔与三取代硅烷高效、高选择性的硅氢化反应。该反应在温和条件下进行,表现出良好的官能团耐受性、很高的活性、广泛的底物范围,为烯基硅的合成提供了有效方法。该反应展现出独特的活化试剂效应,即活化试剂不同时,反应区域选择性截然相反。在芳基烷基内炔的硅氢化中,当使用AliBu3作为活化试剂时,给出顺式α-加成选择性;而使用NaBArF的作为活化试剂时,则给出顺式β-加成选择性。机理实验表明,不同的添加剂会生成不同价态的活性钴催化剂,而价态的不同导致了催化剂经历了不同的自旋多重度,最终导致了区域发散性结果。而结构拥挤的偕二芳基取代环丙烷双膦配体与小半径3d金属钴的组合,形成了紧凑的反应空腔,能够识别炔烃两端取代基的微小差异,从而保证了优异的区域选择性。上述研究不仅为三取代烯基硅单体的合成提供了高效方法,发现了新颖的添加剂效应,以及添加剂通过改变金属催化剂价态调控反应区域选择性的新途径,为催化剂和催化反应设计提供了新思路。
相关成果近期发表于CCS Chemistry(https://doi.org/10.31635/ccschem.025.202405338),张艳东博士和博士生刘祥雨是文章的共同第一作者,朱守非教授是文章的通讯作者。
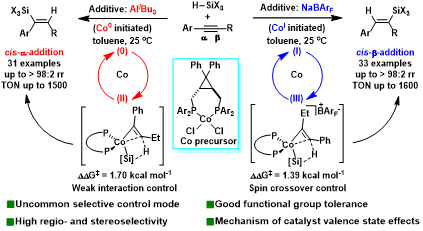
图1 添加剂调控的区域发散性炔烃硅氢化反应
首先作者以1-苯基-1-己炔为模板底物,以HSi(OEt)3为硅氢化试剂,系统研究了活化试剂,配体,金属及溶剂等对炔烃硅氢化反应的影响。(表1)。当以AliBu3作为活化试剂时,能够以最优的收率及选择性获得cis-α-加成硅氢化产物。当使用NaBArF为活化试剂时,反应区域选择性发生了逆转,生成的产物以cis-β-加成选择性为主。
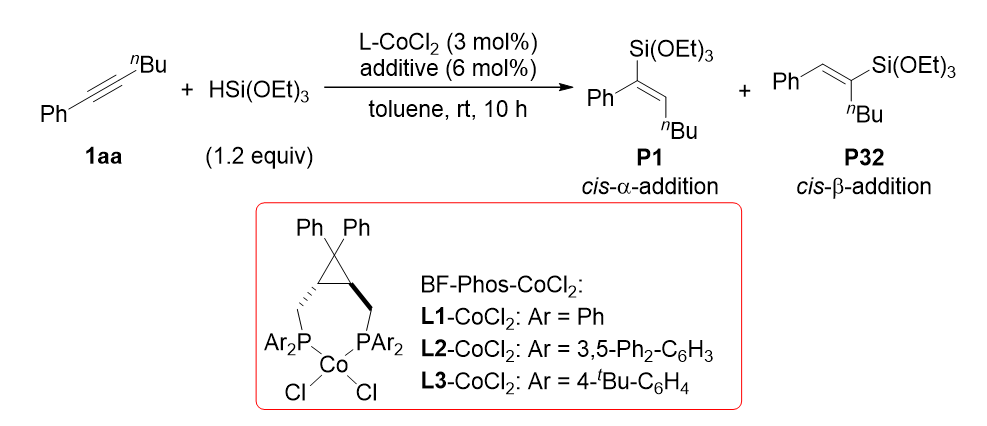
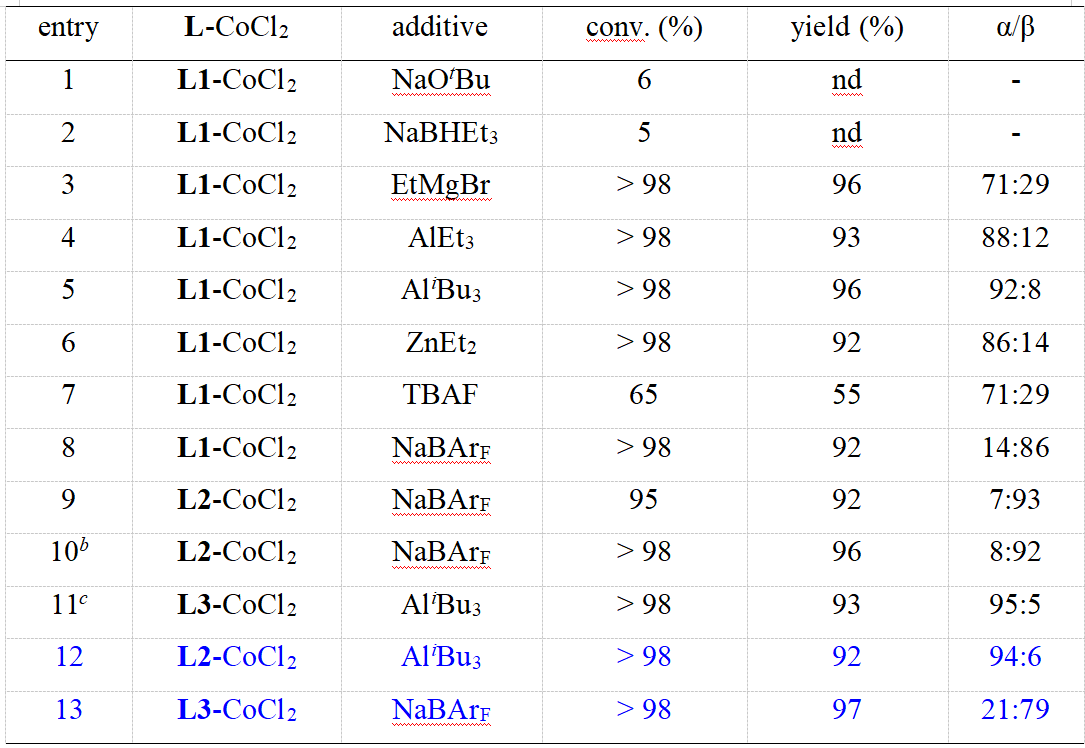
表1 添加剂对硅氢化反应的影响
作者对以AliBu3为活化试剂的芳基烷基内炔α-加成硅氢化的底物适用范围进行了考察(图 2)。结果表明,芳基上取代基无论是在苯环的邻位、间位或对位,均对反应均没有影响。芳基取代基的电性对硅氢化反应活性的影响也不大,其中芳环越缺电子,区域选择性越高。该反应具有良好的官能团兼容性,当苯环上有硅基,酰胺或缩醛等官能团取代时,硅氢化反应可以顺利发生。其它芳基取代基,如萘基,呋喃或噻吩等取代的内炔底物也适用于该反应。内炔另一端取代基为烷基时,烷基取代基的位阻越大,硅氢化反应的区域选择性越好。当烷基末端具有卤素,酯基,硅醚,碳碳双键取代时,可以与硅氢化反应兼容。
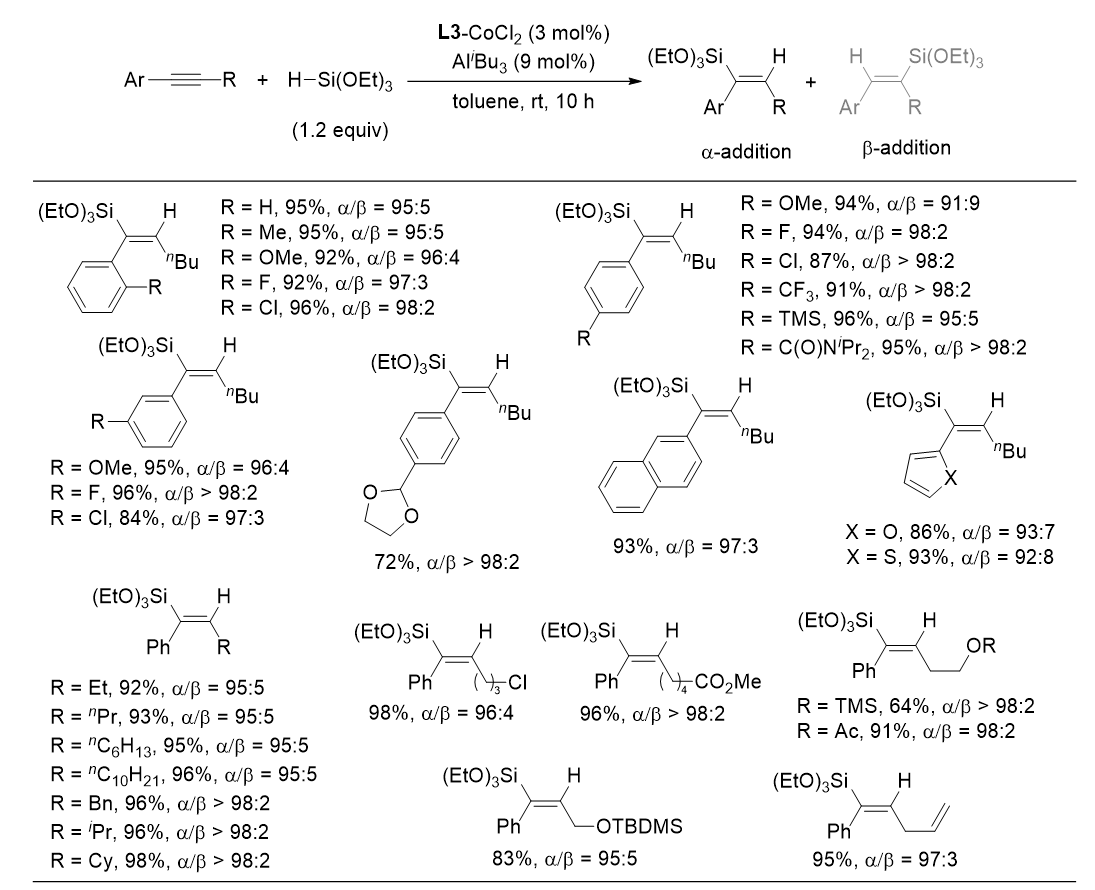
图2 芳基烷基内炔α-加成硅氢化的底物适用范围
随后作者以NaBArF作为活化试剂,对钴催化芳基烷基内炔β-加成硅氢化的底物适用范围进行了评价(图 3)。当以苯基-链状烷基取代内炔为底物时,都可以顺利发生硅氢化反应,其中内炔的烷基链长度对反应影响不大。芳基上取代基的位置与电性对硅氢化反应的影响不显著,芳环富电性越强,区域选择性越高。该体系可以耐受胺基,硫醚,硅醚,酯基,缩醛等官能团。除了芳基取代基,该体系适用于具有胡椒环,萘基,苯并呋喃,吲哚,噻吩,二茂铁等芳香体系取代的内炔底物。该体系还适用于分子内二炔或三炔的多次硅氢化反应。

图3 芳基烷基内炔β-加成硅氢化的底物适用范围
随后,作者评价了BF-Phos-CoCl2搭配AlEt3在双烷基内炔硅氢化反应中的表现(图 4)。该反应能够很好地识别差异很小的甲基和乙基,从而实现2-戊炔的高选择性硅氢化反应。固定炔烃一端取代基为甲基,另一端取代基为长链烷基或苄基时,反应的活性与选择性依旧良好。该反应可以容纳碳碳双键,醚类及磺酸酯基等官能团。此外,该催化体系适用于硅基取代内炔,能够以单一的加成选择性得到硅基处于反式的烯基二硅类化合物。且经过多次炔烃硅氢化反应,可以获得硅基-烯基-硅基-烯基-硅基交替出现的新颖结构,可能在材料化学领域有所应用。
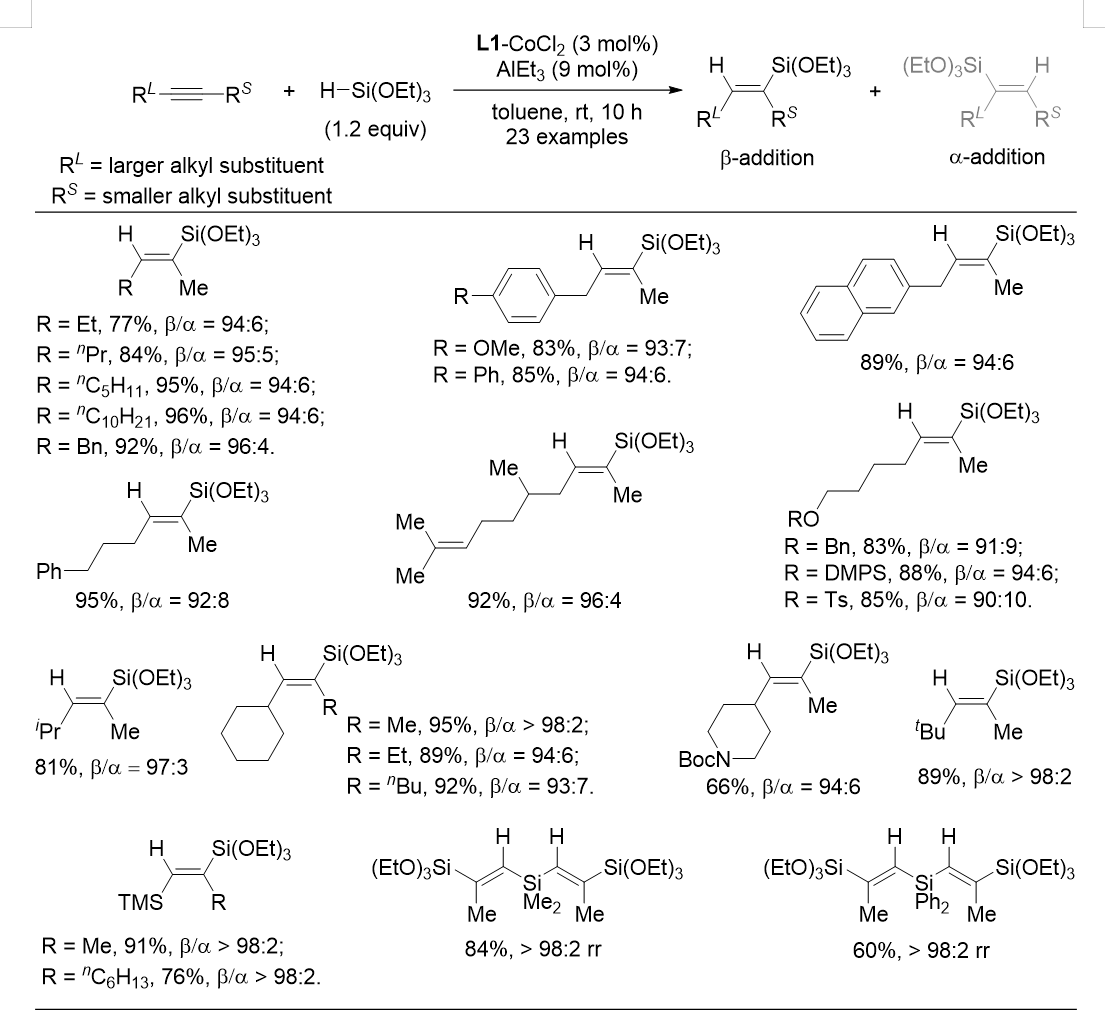
图4 双烷基内炔β-加成硅氢化的底物适用范围
高转化数实验和产物转化实验展示了该反应的合成应用前景(图5)。
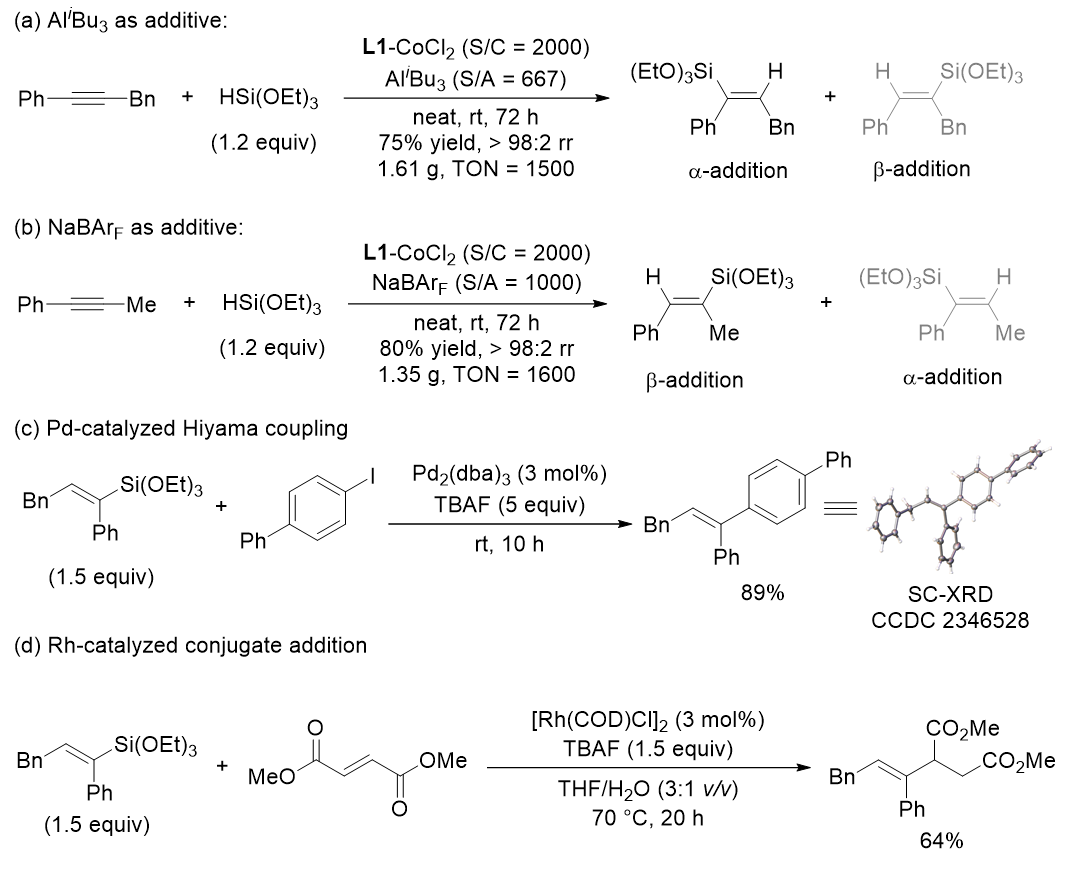
图5 高转化数实验和产物转化实验
作者开展了系列机理实验(图6)。二价钴前体L1-CoCl2通过钠/萘还原体系可以还原为零价L1-Co-COD(单晶确认结构)。该催化剂与以AliBu3作为活化试剂的硅氢化反应体系取得的结果十分类似,因此作者认为该反应体系的活性催化剂为零价钴物种。
作者以零价L1-Co-COD与单电子氧化剂[Fc][BArF]原位生成的阳离子一价钴为催化剂时,与以NaBArF作为活化试剂的反应体系取得的区域选择性一致。因此作者认为当前反应体系的活性催化剂为阳离子一价钴。此外,作者也尝试向零价钴催化体系中添加NaBArF,结果得到的产物依旧以α-加成为主。综上所述,作者认为在该钴催化内炔硅氢化反应中,以AliBu3为活化试剂时,反应的活性催化剂为零价钴;而以NaBArF为活化试剂时,活性催化剂为阳离子一价钴物种。
自由基捕获实验表明,两种催化体系都基本可以排除自由基机理。混合硅烷实验都没有观察到氢氘交换产物,基本排除了反应由Co-H或Co-Si启动的可能。动力学实验KIE(AliBu3)为1.2,KIE(NaBArF)为1.0。结果表明Si-H的断裂并非反应的决速步。
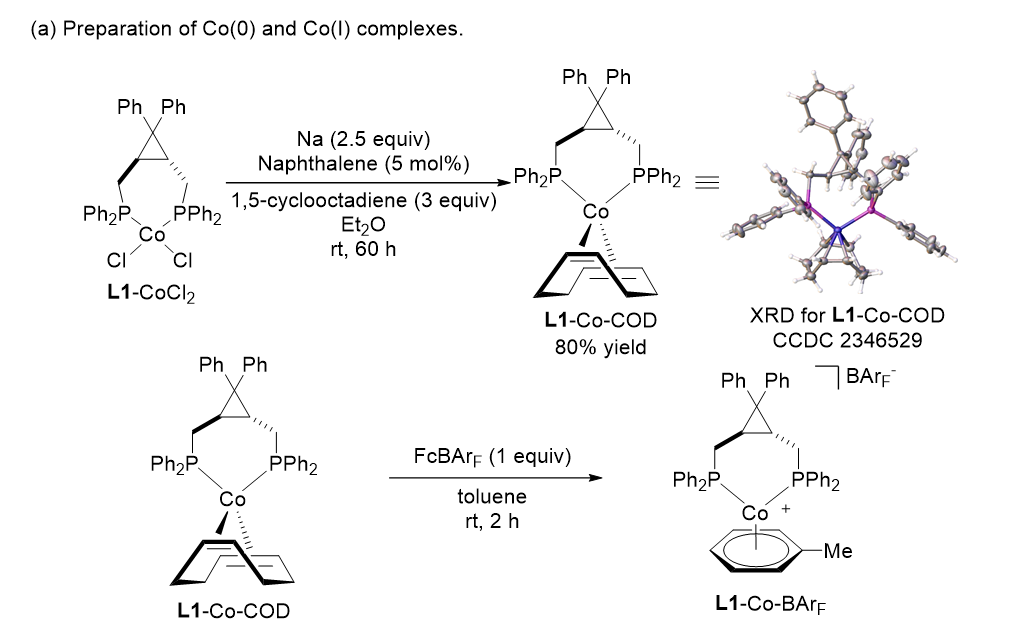

图6 机理实验
作者根据以上机理实验,提出了以下催化循环(图7)。
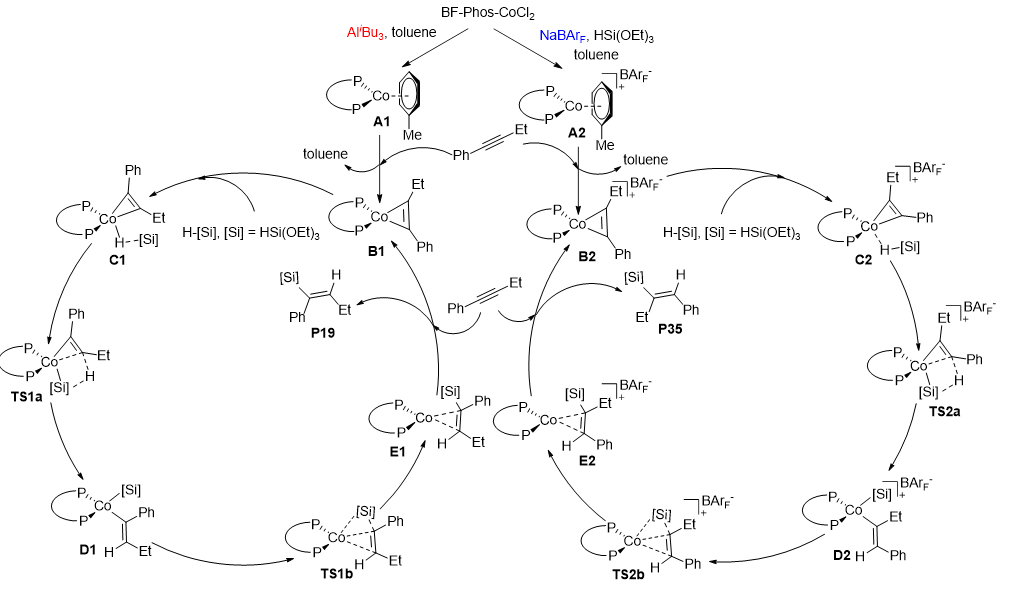
图7 催化循环
随后作者进行了详细的DFT计算研究,将1-苯基-1-丁炔与三乙氧基硅烷作为模板底物,分别研究了AliBu3和NaBArF这两种添加剂存在下硅氢化反应的催化途径和相关能量(图8)。DFT计算表明三乙氧基硅烷的和催化剂的非共价作用为进一步钴对硅氢键氧化加成提供动力,且配体到配体的氢转移(LLHT)均为反应的选择性决定步骤。
对于AliBu3作为添加剂的催化体系,过渡态2TS1a1与2TS1a2能量相近,过渡态能垒差异来源于中间体2C11与2C12的能量差异。对中间体C11与C12进行了IGMH分析发现,2C12炔烃上的苯环与配体膦上的苯环存在Π···Π堆积作用,从而使其能量低于2C11。所以相比之下顺式α加成的选择性过渡态能垒更低,从而得到顺式α加成的产物。此外作者还观察到了反应过程中的自旋交叉现象。分析四重态中间体D1表明,金属钴相较于二重态空轨道数更少,完全失去了对氢原子的控制从而更加稳定。自旋图显示,2TS1a1、2TS1a2中自旋主要分布在金属中心,4D11、4D12中硅原子与炔烃碳原子上有着一定的自旋离域,表明自旋变化在配体到配体的氢转移过程中起到了关键作用。DFT计算显示,LLHT过程中顺式β加成相较于顺式α加成过程可逆性更强,使得反应更容易生成顺式α加成的硅氢化产物。随后反应经历还原消除过程,DFT计算表明顺式α加成选择性中还原消除是反应的速率决定步骤。
对于NaBArF作为添加剂的催化体系,顺式β加成选择性会存在从三重态到单重态的自旋交叉现象,降低了催化能垒。而顺式α加成选择性则始终处于较高能量的三重态,因此得到顺式β加成选择性产物。为了解释发生自旋交叉的原因,作者对过渡态TS2a进行了二面角和电荷分析,发现Si-Co-H平面和Co-H-C平面之间的二面角θ(Si-Co-H-C)对H原子电荷有着重要影响。比较发现二面角越大,也就是说Si,Co,H,C四个原子平面性越好,H原子的正电性就越强。这可能与H原子轨道与Co,Si,C原子的轨道重叠程度有关。对于顺式α加成选择性,氢会转移到烷基一侧的炔烃碳C1上,在过渡态TS2a1中1TS2a1,3TS2a1的C1碳呈现电中性,而3TS2a1中H原子电荷高于1TS2a1,从而更容易转移到C1上。而对于顺式β加成选择性,氢会转移到芳基一侧的炔烃碳C2上。在过渡态TS2a2中,1TS2a2,3TS2a2中的C2碳呈现一定的正电性,且3TS2a2中的C2碳正电性更强。3TS2a2中带正电的H原子转移到C2碳上会存在一定的静电排斥作用,相比之下1TS2a2中电中性的H原子则更容易转移到带有一定正电的C2碳上。作者认为这可能是一价阳离子钴在LLHT过程中存在自旋交叉现象的原因。同时作者发现1D22能量显著低于1D21,使得一价钴催化的的顺式α加成相较于顺式β加成过程可逆性更强,使得反应更容易生成顺式β加成的硅氢化产物。
对于双烷基内炔烃的顺式-β加成选择性来源,作者认为是LLHT过程中两个区域选择性过渡态之间的能量差异造成的。添加剂的评价表明,AlEt3与AliBu3具有相似的反应性,因此双烷基内炔烃的顺式-β加成选择性很可能仍处于Co(0)/Co(II)循环中。根据现有的计算结果,作者认为能量差异来自对催化剂和烷基炔烃之间空间位阻的识别,三烷氧基硅基这加成在空间位阻较低甲基一侧。
机理实验表明,对于AliBu3和NaBArF这两种添加剂存在下硅氢化反应对含氧硅烷活性更高。在C1、C2中作者观察到了氧原子与配体上的氢产生的C-H-O相互作用,E1、E2中还观察到了Co-O相互作用,作者因此认为O原子对整个催化循环起到了关键作用。
作者对比了AliBu3和NaBArF这两种添加剂存在下的硅氢化反应,零价钴与一价钴活性物种采用了类似的催化循环,但由于催化剂所带电荷不同,使得反应过程经历了不同的自旋多重度,最终得到了不同选择性的产物。但LLHT均为选择性决定步骤,该基元步骤中零价钴与一价钴也同样表现出了一定的可逆性,这更有助于得到高选择性的产物。此外,LLHT中包含金属钴中心对硅氢键的氧化加成,但与传统氧化加成步骤中中心金属价态上升有所不同,通过电荷分析作者发现零价钴与一价钴在配体配体氢转移过程中金属钴中心均得到了显著的还原,同时伴随着Si原子与H原子的正电性增强。这表明LLHT这种环状协同过渡态中富电子的钴中心更有利于发生该过程。
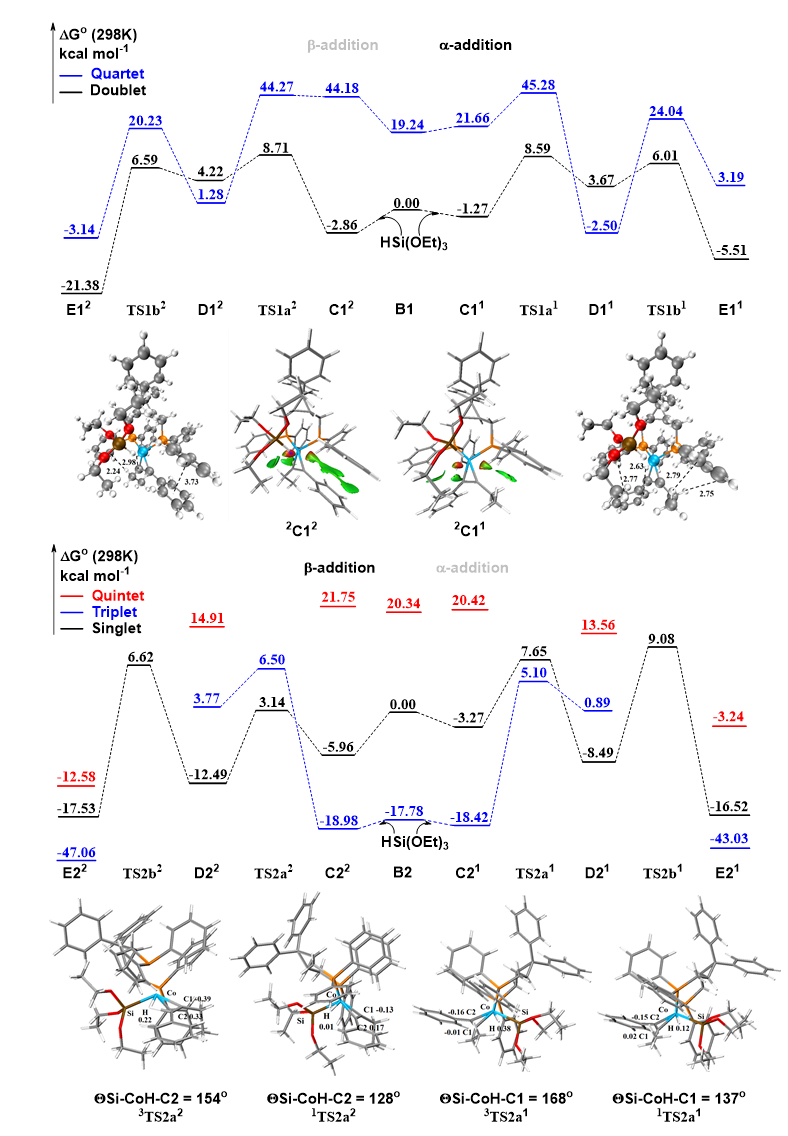
图8 DFT计算
总之,朱守非课题组使用环丙烷骨架双膦配体钴配合物作为催化剂,实现了非对称内炔与三取代硅烷的高区域选择性硅氢化反应,具有条件温和、操作简单、底物适用范围与官能团兼容性好以及效率高等特点。该反应中,不同的添加剂会生成不同价态的活性钴催化剂,而价态的不同导致了催化剂经历了不同的自旋多重度,最终导致了区域发散性结果。上述研究为三取代烯基硅单体的合成提供了高效方法,发现了添加剂通过改变金属催化剂价态调控反应区域选择性的新途径,为催化剂和催化反应设计提供了新思路。
