Copper-Catalyzed Highly Enantioselective Ring-Opening/Cyclopropanation of 1-Silylcyclopropenes
铜催化1-硅基环丙烯的开环/不对称环丙烷化反应
手性环丙烷骨架广泛存在于药物,天然产物等生物活性分子当中。过渡金属催化卡宾对烯烃的不对称环丙烷化是构筑光学活性环丙烷化合物的有效方法。然而,这些反应中大部分都是使用α-C取代的卡宾,转化潜力更加丰富的α-硅基卡宾的高对映选择性环丙烷化反应却鲜有报道。并且卡宾前体主要局限于重氮类化合物,硅基卡宾的需要另一侧吸电子酯基来稳定,在一定程度上限制了环丙烷产物的结构类型。
环丙烯作为高张力环系,具有丰富的反应性,能够在过渡金属催化下发生开环生成烯基金属卡宾。当烯基上面连有硅基时,硅基能够诱导开环的区域选择性生成α-硅基-α-烯基卡宾,进而发生系列卡宾转移反应。近年来,南开大学朱守非课题组长期致力于金属卡宾的不对称转移反应研究。近期,该课题组实现了铜(Ⅰ)催化下硅基环丙烯衍生的α-硅基-α-烯基卡宾的高对映选择性不对称B-H键插入反应(Angew. Chem. Int. Ed. 2022, 61, e202203343.)。在本工作中,该课题组将这类结构独特的α-硅基-α-烯基卡宾用于烯烃不对称环丙烷化反应,在手性双噁唑啉配体修饰的Cu(I)催化剂作用下,将烯丙基硅结构引入环丙烷骨架,高效、高选择性地合成了一系列的含季碳手性中心的环丙基硅化合物。当使用共轭二烯时,环丙烷还能进一步发生Cope重排生成1,4-环庚二烯类有机硅化合物。本研究为含有有机硅骨架功能分子的发现与构筑提供了新的物质基础。相关成果发表在Chin. J. Chem. 2025, http://doi.org/10.1002/cjoc.70100。
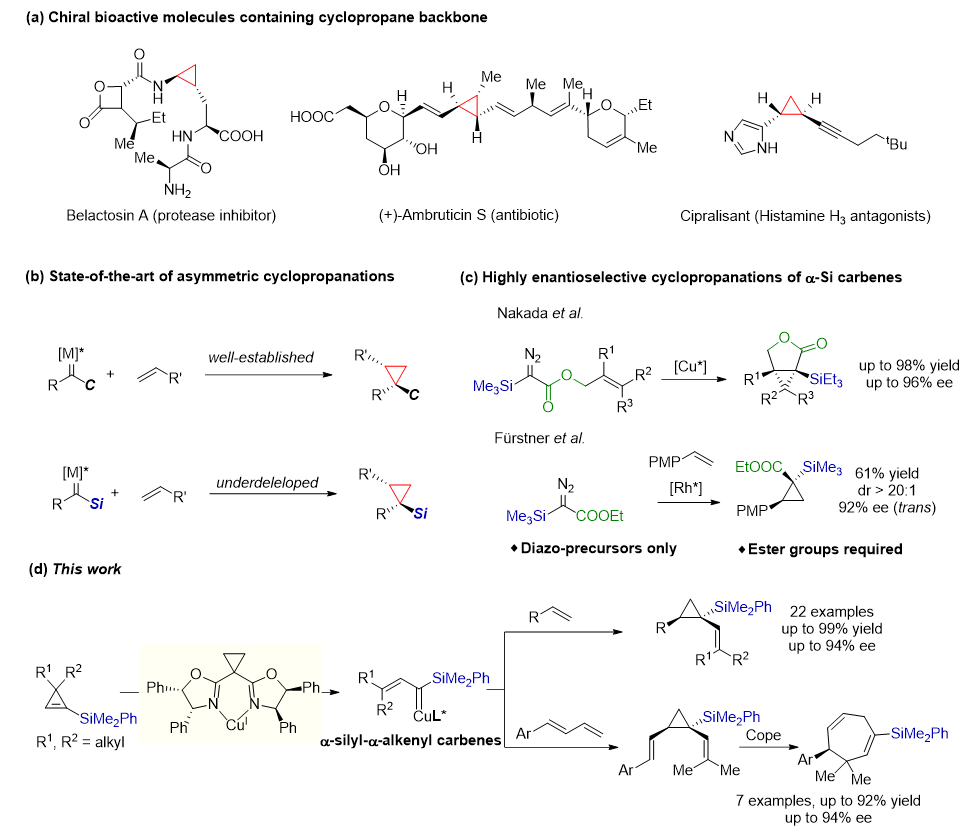
图1 α-硅基卡宾的不对称环丙烷化反应
他们首先使用3,3-二甲基-1-硅基环丙烯与苯乙烯作为标准底物,经过条件优化后,确定反应的最佳反应条件为:以2当量的1-硅基环丙烯和一当量的烯烃为底物,10 mol% Cu(MeCN)4PF6为金属前体,使用12 mol%的手性双噁唑啉配体,以1,2-二氯乙烷为反应溶剂,在室温条件下反应72 h。
在最优条件下,他们对底物适用范围进行考察。当烯烃芳基邻位有甲基取代时,可能由于位阻增大,收率显著降低但ee值得到保持,而邻位甲氧基由于位阻较小,能得到优异的收率和ee值;芳基间位取代基对反应影响较小。当苯环对位为苯基或者给电子的甲氧基、烷基、卤素时,均能得到良好的收率和对映选择性。然而,当苯环上对位带有强拉电子的三氟甲基时,反应活性显著降低,几乎得不到目标产物。带有稠环、胡椒环、杂芳环取代基的烯烃,与杂原子相连的官能团化端烯以及雌酚酮衍生的端烯均能得到优异的结果。其他的环丙烯底物如3,3-二乙基-1-硅基环丙烯或3-苯基-3-甲基-1-硅基环丙烯,可能由于位阻原因,反应几乎观察不到环丙化产物。
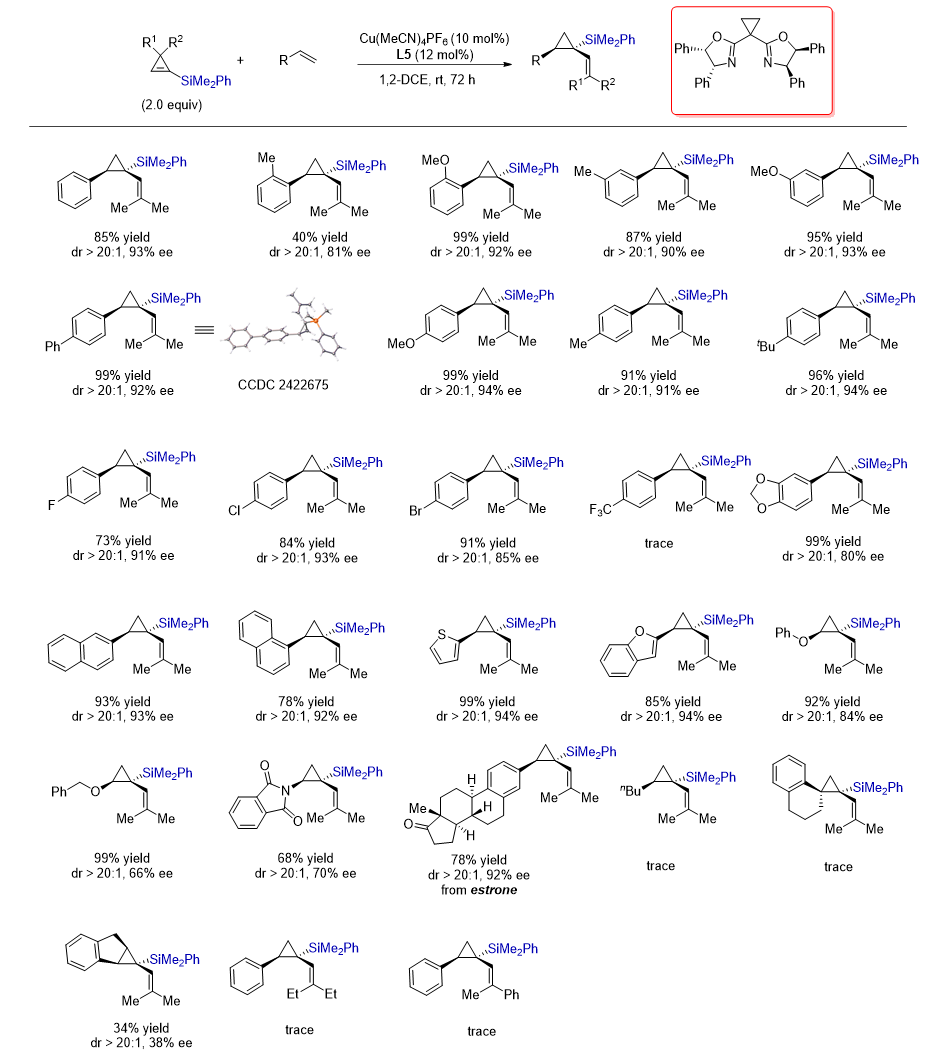
图2 1-硅基环丙烯的开环/不对称环丙烷化反应
有趣的是,芳基共轭二烯发生上述环丙烷化反应以后,只需要将体系升温到40 ℃,就能够发生Cope重排,对映选择性保持地转化为手性环庚二烯基硅(图 3)。这类反应的发现,丰富了手性有机硅的种类,为其后续功能研究奠定了物质基础。
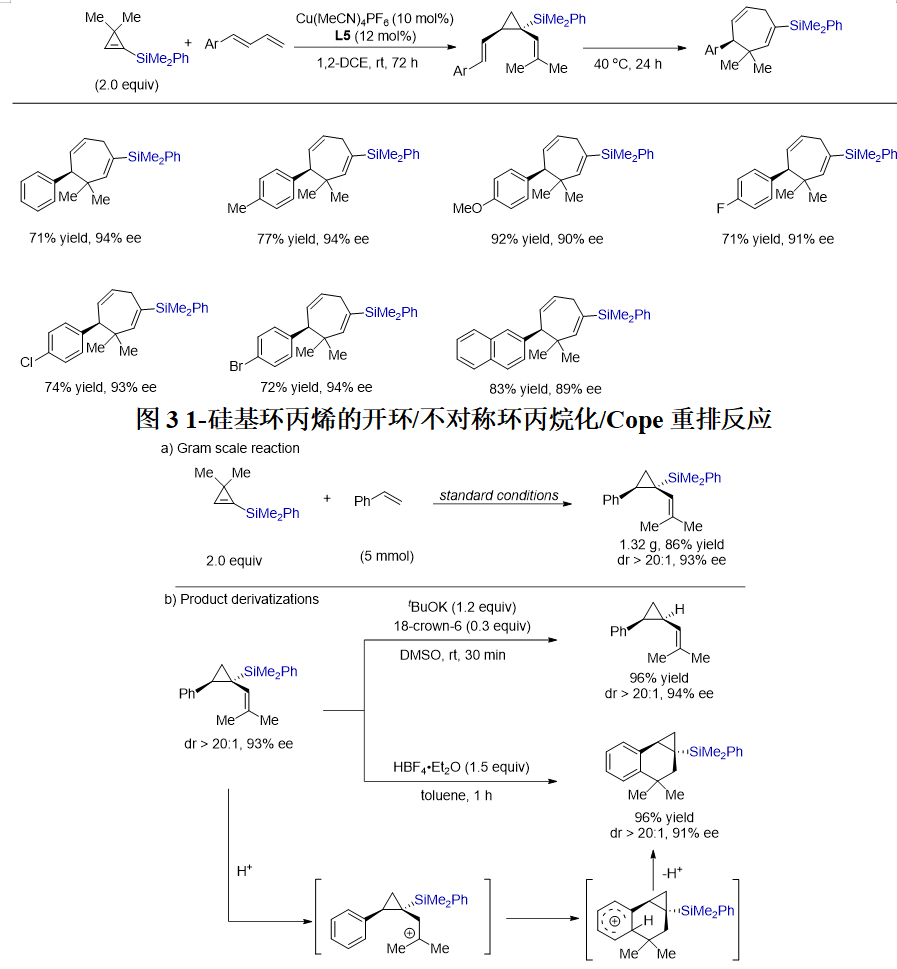
图4 1-硅基环丙烯的开环/不对称环丙烷化反应克级规模实验和产物转化
为了考察反应的应用潜力,他们首先进行了克级规模实验。在标准反应条件下,能以86% 的分离收率和93% ee的对映选择性获得1.32 g目标产物。随后,他们对环丙烷化产物进行产物转化,在叔丁醇钾和18-crown-6的作用下,以DMSO作为反应溶剂,得到脱硅产物,其非对映选择性和对映选择性均能得到保持。有趣的是,使用四氟硼酸为催化剂,该烯丙基硅结构能够发生分子内傅-克反应得到并环产物。对于其机理,他们认为首先是烯烃与氢离子作用,生成三级碳正离子,随后对环丙基同侧的苯环进行亲电进攻,随后脱质子生成产物。这种具有并环结构的含硅手性环丙烷化合物是一类新的手性有机硅化合物。
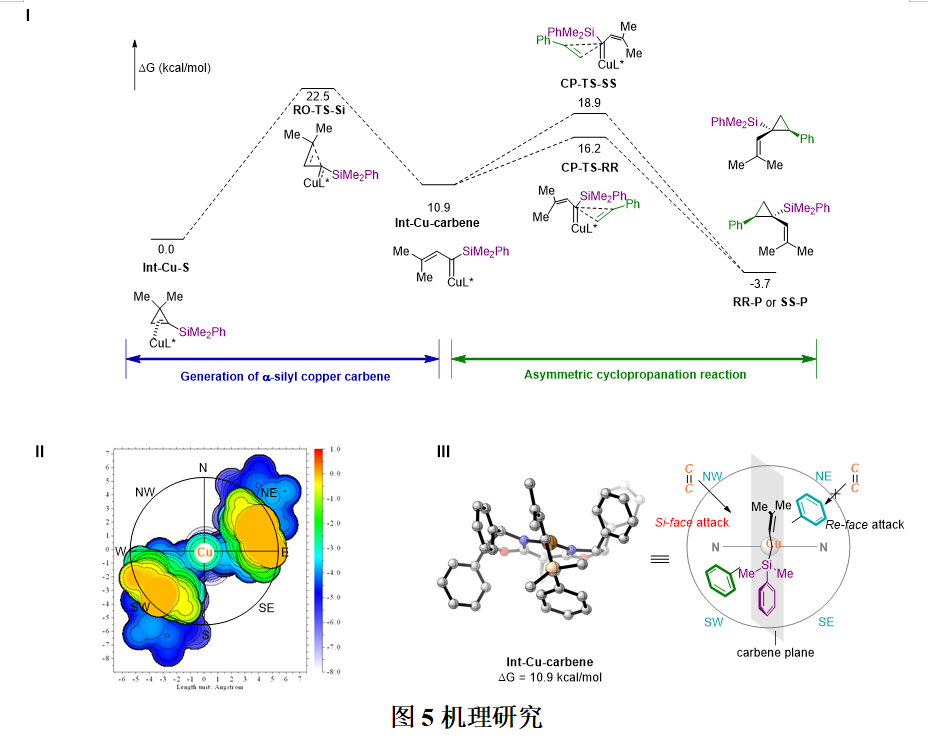
为了进一步了解反应过程以及探究选择性的来源,他们对反应过程进行了DFT计算(图 5, I)。计算表明,硅基环丙烯的开环过渡态的能量为22.5 kcal/mol,为反应的决速步。生成(R,R)构型产物的过渡态的能量比(S,S)构型低2.7 kcal/mol,与实验得到(R,R)构型产物的结果相符。之后,为进一步分析过渡态能量差以及选择性的来源,他们绘制了铜卡宾中间体的位阻图,结果表明卡宾东北区域和西南区域被噁唑啉配体上的苯环所屏蔽,卡宾部分坐落在由西北到东南形成的一道沟壑当中(图 5, II)。庞大的硅基屏蔽了整个南部区域,因而烯烃只能从西北方向(Si面)进攻,得到(R,R)构型的产物(图 5, III)。硅基在反应中有两个作用,一是诱导环丙烯开环的区域选择性,生成α-烯基-α-硅基卡宾,二是硅基的大位阻与刚性有利于环丙烷化过程的手性控制。
总之,朱守非课题组使用铜(I)搭配手性双噁唑啉配体,成功实现了取代环丙烯衍生的α-硅基卡宾的不对称环丙烷化反应,该反应条件温和,适用于芳基乙烯、烯基醚和烯基酰亚胺,能够以优异的产率(up to 99% yield)和对映选择性(up to 94% ee)合成一系列含有季碳中心的手性环丙基烯丙基硅化合物。其中,和共轭二烯的环丙烷化反应还可以通过简单的升温,发生串联的Cope重排,生成手性环庚二烯基硅。本研究为含有有机硅骨架功能分子的发现与构筑提供了新的物质基础。
