Research: Chiral Ligands with 1,10-Phenanthroline Scaffold for Copper-Catalyzed Enantioselective C(sp3)−H Bond Amidation
邻菲罗啉骨架的手性配体及其在铜催化对映选择性C(sp³)−H键酰胺化反应中的应用
手性配体的设计与合成一直是不对称过渡金属催化的研究焦点。尽管在过去几十年已发展了众多手性配体,但大多数配体仅在特定反应中表现出高对映选择性。因此,开发新的手性配体实现更多反应的对映选择性有效控制具有重要研究价值。邻菲罗啉(1,10-phenanthroline)是一类重要的双齿氮配体,其形成的金属配合物已在多种反应中展现出优异的催化性能。然而,手性邻菲罗啉配体仅有零星的成功案例,这主要源于两个内在限制:(i) 邻菲罗啉的平面芳香骨架缺乏sp³杂化中心,难以在骨架上直接引入手性片段;(ii) 向邻菲罗啉骨架上模块化安装手性片段缺少有效方法。
南开大学化学学院朱守非课题组长期致力于基于邻菲罗啉骨架配体的合成与反应性研究。近年来发展了多种基于邻菲罗啉骨架的配体及其铁配合物,并将其成功应用于多种烯烃和炔烃的硅氢化、硼氢化、氢铝化和碳锌化等反应(Natl. Sci. Rev. 2024, 11, nwad324; J. Am. Chem. Soc. 2025, 147, 15545; 2022, 144, 515; 2020, 142, 16894; 2019, 141, 4579; Angew. Chem. Int. Ed. 2024, 63, e202402044; Nat. Commun. 2018, 9, 221; CCS Chem. 2024, 6, 537; ACS Catal. 2022, 12, 2581; Chem. Sci. 2022, 13, 2721; 2022, 13, 7873; Org. Lett. 2023, 25, 5646; Chin. J. Chem. 2023, 41, 3547; Chem. Eur. J. 2024, 30, e202403437)。在上述研究基础上,该课题组建立了一个基于酰胺化反应的模块化合成C₂-对称2,9-二芳基菲罗啉配体的方法,高效构筑了一系列邻菲罗啉骨架的手性配体,并将这些配体用于铜催化甲磺酰氧基氨基甲酸酯的不对称分子内氮宾C(sp³)-H插入反应,获得该类反应迄今最高的对映选择性(88:12 er,图1)。该研究为邻菲罗啉骨架手性配体的合成提供了新思路。相关成果发表在Synthesis 2025, https://www.thieme-connect.com/products/ejournals/issue/aam/10.1055/s-00000084,李小玉是文章第一作者。
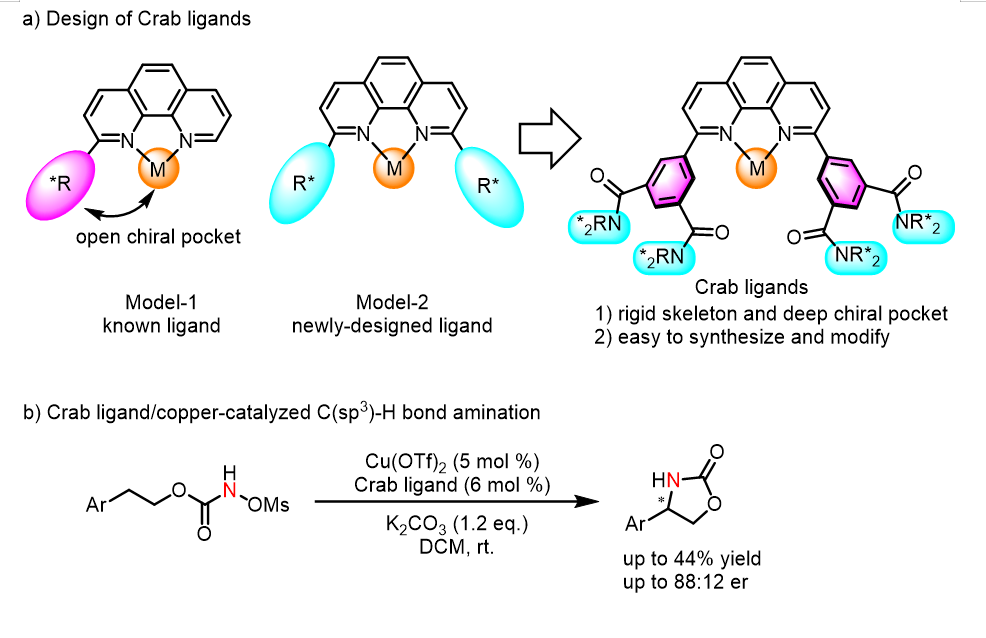
图1 Crab配体的设计合成与铜催化对映选择性 C(sp³)−H 键酰胺化
以2,9-二氯菲罗啉为起始原料,通过Suzuki-Miyaura偶联和水解反应引入3,5-双羧酸基苯基,随后和多种手性胺的酰胺化反应引入手性砌块,可快速构建目标配体库(Crab配体,图2)。这个三步路线最显著的特点就是可以通过酰胺化反应模块化引入手性结构。配合物单晶结构显示,配体在铜中心构筑了一个C2对称性的手性口袋。
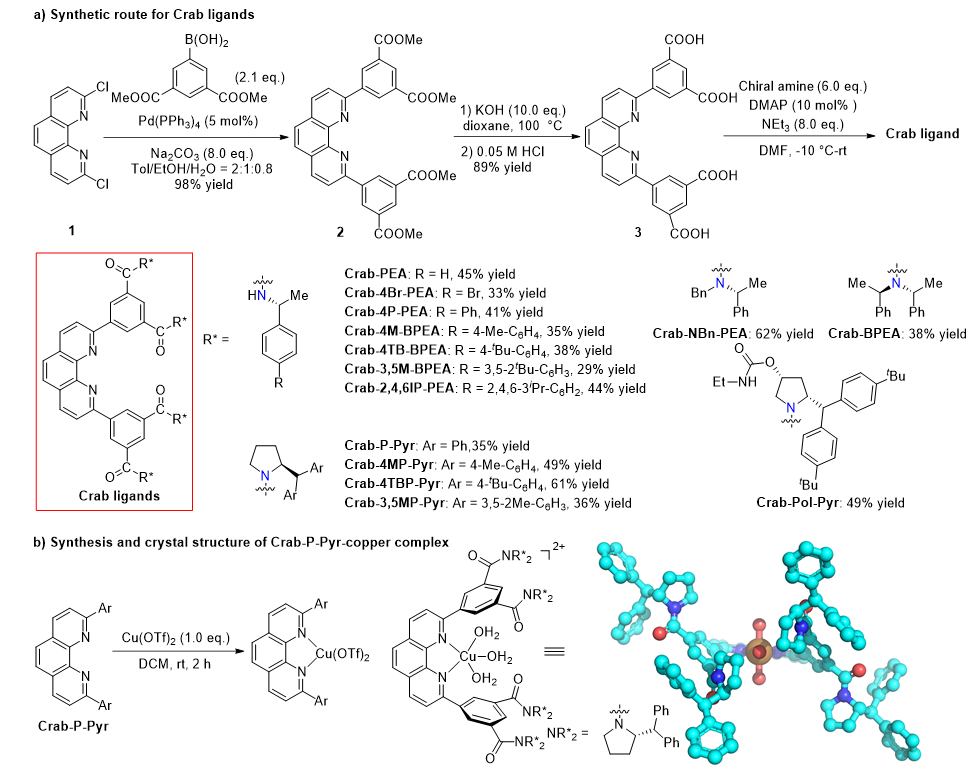
图2 Crab配体的合成及其铜配合物晶体结构
将Crab配体应用于铜催化的氨基甲酸酯的分子内C(sp³)-H胺化反应中,获得最高88:12 er的对映选择性(图3),这代表了同类反应的最好水平。
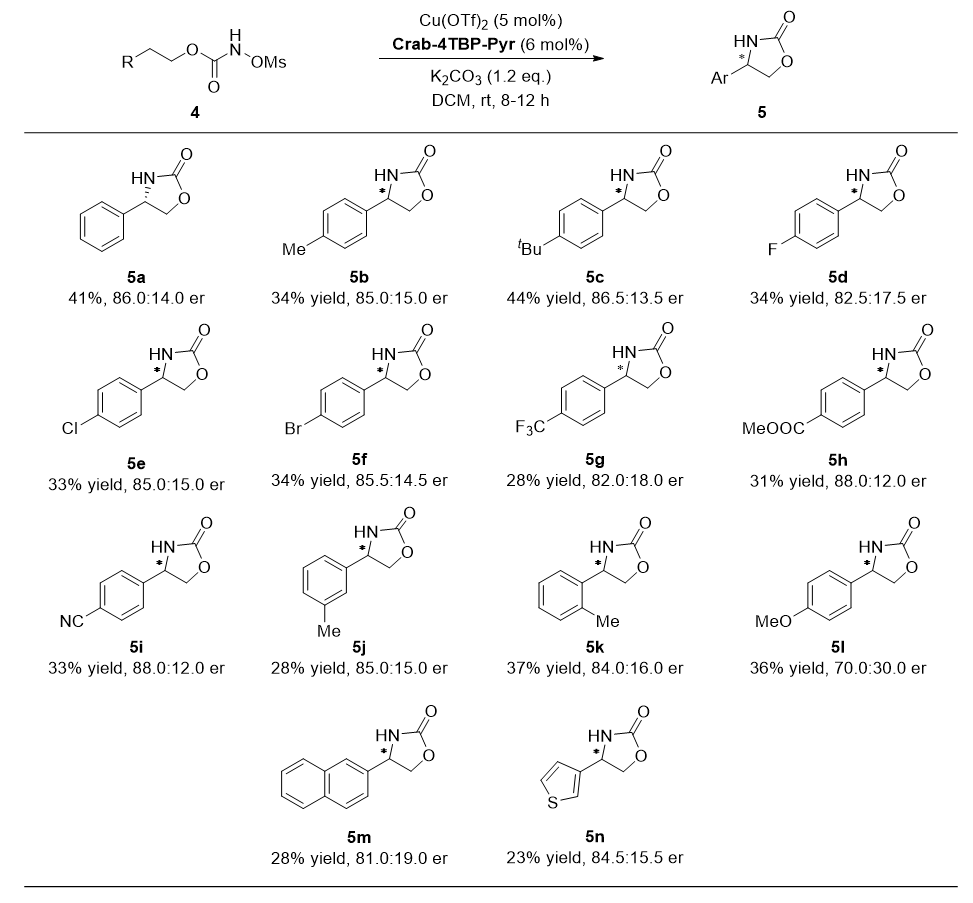
图3 铜催化对映选择性 C(sp³)−H 键酰胺化反应
该反应可能经历以下机理:碱介导的底物去质子化引发甲磺酸酯消除,生成铜-氮宾中间体;该氮宾物种经历1,5-氢原子转移,形成烷基自由基;立体选择性诱导发生在自由基向Cu中心靠近成键的过程中,配体的手性口袋通过底物芳基与2,9-芳基酰胺取代基之间的立体效应实现对映选择性控制(图 4)。该反应存在很多竞争反应途径,造成目标产物收率不高。
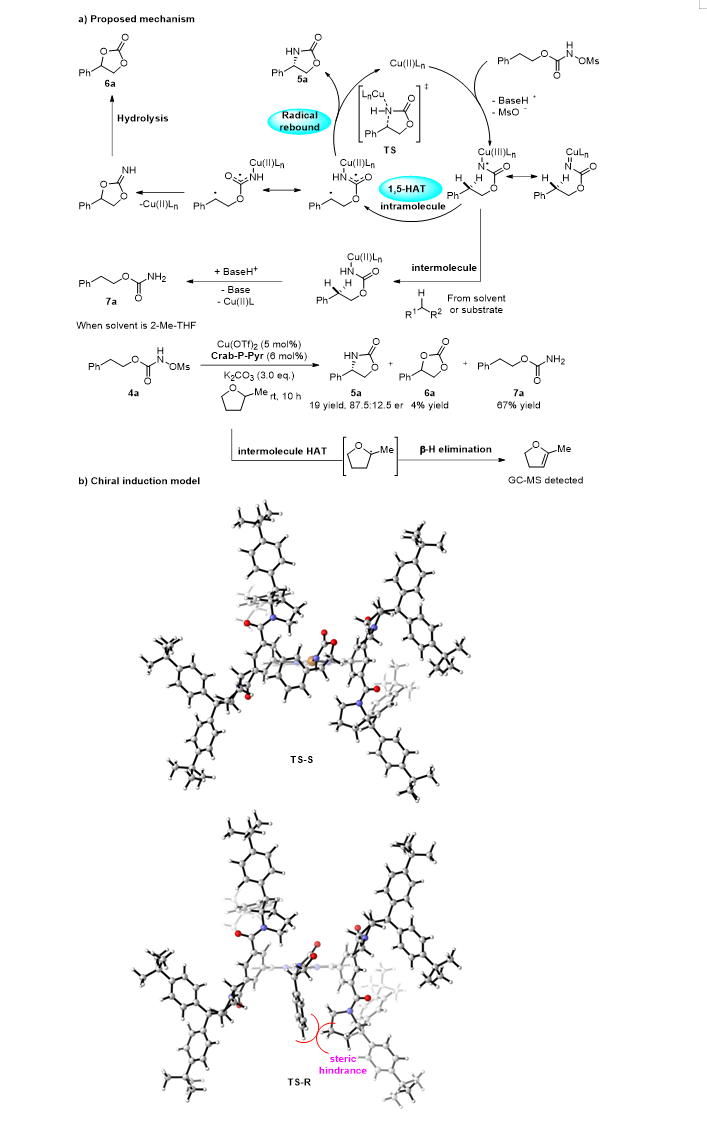
图4 可能机理和手性诱导模型
总之,该研究发展了一种模块化构筑邻菲罗啉骨架手性配体的方法,为丰产金属催化的不对称有机合成反应提供了新的工具。
